Vesinik
Ülevaade
Vesinik on kõige lihtsama aatomiehitusega element. Vesiniku aatomi tuumas on ainult üks prooton, mille ümber tiirleb üks elektron. Lihtainena esineb vesinik dimeerina (H2) ning kahe vesiniku vahel olev kovalentne side on väga püsiv – vesinik võib toatemperatuuril reageerida ainult kloori ja fluoriga, teiste mittemetallidega reageerimisel on vaja kõrgemat temperatuuri.
Sulle võivad huvi pakkuda need õppematerjalid:
Растворы
Атомы и молекулы
Ioonid
Ионы
Aatomid ja molekulid
Lahused
Tutvus keemiaga
Oksüdatsiooniaste
Знакомство с химией
Vesiniku aatom võib liita, kui ka loovutada elektroni. Liites ühe elektroni, tekib negatiivne hüdriidioon (H–), loovutades elektroni, tekib positiivne vesinikioon (H+). Vesilahustes on vesinikioon alati endaga sidunud ühe vee molekuli ning esineb vees hüdrooniumioonina (H3O+).
Vesiniku peamised kasutusalad on keemia- ja naftatööstus. Suur osa vesiniku toodangust kulub teiste ainete (ammoniaak, metallid, soolhape, jt) saamiseks. Metallurgias kasutatakse vesiniku puhaste metallide redutseerimiseks nende maakidest
CuO + H2 = Cu + H2O
Tänapäeval leiab vesinik vähesel määral juba kasutust ka energiaallikana (puhta kütusena automootorites ning kütuseelementides elektrienergia tootmiseks). Tulevikus loodetakse vesiniku kasutamist kütusena suurendada, kuid selleks peab tagama tingimused vesiniku ohutuks hoiustamiseks ja transportimiseks – vesiniku ja hapniku segu on väga plahvatusohtlik.
Universumis leidub vesinikku kõige rohkem – kuskil 90% kogu universumist koosneb vesinikust. Tähtedel toimub pidevalt tuumareaktsioonid, kus vesinikuaatomid ühinevad heeliumi aatomiks ning seejuures eraldub suur hulk energiat.
411H+ = 24He + 2e+ + energia
Füüsikalised omadused
Lihtainena on vesinik lõhnatu ja värvitu gaas. Vesinik on kõige kergem gaas, mis on õhust 14,5 korda kergem. Vesiniku keemistemperatuur on -253 oC. Kuna vesiniku molekulid on väga väikesed, siis läbib vesinik kergesti poorseid materjale, isegi õhukest metalli. Vesinikku transporditakse madalal temperatuuril ning rõhul, kuna kõrgematel temperatuuridel tungib vesinik läbi anuma seinte.
Vesinikku kasutati tema kerguse tõttu õhulaevades. Tänapäeval seda enam ei tehta, kuna vesiniku ja hapniku segu (vesiniku-hapniku segu 2:1 nimetatakse paukgaasiks) on väga plahvatusohtlik ning õhulaeva rikke korral võib see plahvatada. Nii juhtus ka 1937. aastal kui plahvatas vesinikuga täidetud Hindenburgi õhulaev. Peale seda juhtumit lõpetati vesiniku kasutamine õhulaevades ja õhupallides.
Keemilised omadused
Mittemetallidega reageerides käitub vesinik redutseerijana.
H2 + S = H2S
H2 + Cl2 = 2HCl
Vesiniku reageerimisel hapnikuga (vesiniku põlemine) tekib saadusena vesi. Mistõttu on vesinik loodussõbralik kütus.
2H2 + O2 = 2H2O
Aktiivsete metallidega reageerides käitub vesinik oksüdeerijana ning saadusena tekib hüdriid (vesiniku ühend, kus vesiniku o.a on -1). Väheaktiivsete ja keskmise aktiivsusega metallidega vesinik ei reageeri
H2 + 2Na = 2NaH
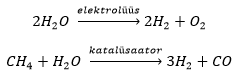
Tööstuses saadakse vesinikku peamiselt kas vee elektrolüüsil või metaani reageerimisel veeauruga katalüsaatori juuresolekul
Laboris on üheks lihtsamaks vesiniku saamise võimaluseks metalli reageerimine lahjendatud happega. Enamasti kasutatakse tsingi reaktsiooni soolhappega.
Zn + 2HCl = ZnCl2 + H2
TEST:
Hapnik ja vesinik. Vali õiged vastused test nr1
Hapnik ja vesinik. Vali õiged vastused test nr2
Lisainfo
- Vesinik: (Vesinik)
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!