AATOMI ELEKTRONSKEEM
Elektronskeem on üks lihtsamaid võimalusi kirjeldamaks aatomi ehitust. Elektronskeemiga kirjeldatakse ära aatomi tuumalaeng ja see, kuidas elektronid paiknevad elektronkihtidel.
Näiteks kaltsiumi elektronskeemi saame kirja panna järgmiselt:
Ca +20| 2)8)8)2)
Aatomi elektronskeemi kirjutamiseks on mõistlik lähtuda allolevatest punktidest:
1. Leidke perioodilisustabelist elemendi järjenumber, mis annab prootonite ja elektronide arvu. Näide: kaltsiumi järjenumber on 20.
2. Perioodi number, milles element asub, annab elektronkihtide arvu. Elektronkihte tähistatakse kaarekestega. Elektronskeem algab algi elemendi sümboli ja tuumalaneu märkimisega. Näide: Kaltsium asub neljandas perioodis.
Sulle võivad huvi pakkuda need õppematerjalid:
Lahused
Oksüdatsiooniaste
Ионы
Атомы и молекулы
Знакомство с химией
Ioonid
Tutvus keemiaga
Aatomid ja molekulid
Растворы
Ca +20| ) ) ) )
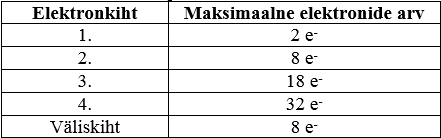
3. Elektronide märkimist elektronkihtidele alustame alati esimestest elektronkihtidest. Esimesele elektronkihile mahub 2 elektroni (vt tabel allpool). Teisele elektronkihile maksimaalselt 8 elektroni (Kui teine kiht on väliskiht, siis on seal enamasti vähem kui 8 elektroni). Näide: Kaltsiumi puhul saame kirja panna järgmiselt
Ca +20| 2 ) 8 ) ? ) ? )
4. Välimise kihi elektronide arvu näitab ära rühma number (A rühmades). Seega saame kirjutada ära ka väliskihil olevate elektronide arvu. Näide: Kaltsium asub II A rühmas, seega on tema väliskihil 2 elektroni.
Ca +20| 2 ) 8 ) ? ) 2 )
5. Puuduolevad elektronkihid täidame nii, et kõigi elektronide arv kokku oleks sama, mis tuumalaeng. Paigutades väiksematele elektronkihtidele maksimaalse arvu elektrone. Näide: Kaltsiumil on seega kolmandas elektronkihis 20 – (2+8+2) = 8 elektroni
Ca +20| 2 ) 8 ) 8 ) 2 )
Elektronide paiknemine elektronkihtidel:
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!