Väärisgaasid
Väärisgaasid asuvad perioodilisustabeli VIIIA rühmas ning tänu oma elektronkatte ehitusele (neil on väliskihis 8 elektroni) on nad väga stabiilsed ning moodustavad ainult üksikuid ühendeid teiste elementidega. Esimesed väärisgaaside ühendid saadi alles 1960ndatel aastatel. Kuni tänaseni pole saadud ühendeid heeliumi ja neooniga, mistõttu on need gaasid tõelised inertgaasid – gaasid, mis ühegi ainega ei reageeri. Kõik väärisgaasid on värvuseta lõhnata vees praktiliselt lahustumatud gaasid. Kõige raskem väärisgaas, radoon on radioaktiivne ning põhjustab ka peamise radioaktiivse taustkiirguse Maal. Õhus leidub kõiki väärisgaase (kõige rohkem leidub õhus argooni (0,93%)), mistõttu toodetakse peaaegu kõiki väärsigaase vedela õhu fraktsioneerival destillatsioonil.
Sulle võivad huvi pakkuda need õppematerjalid:
Oksüdatsiooniaste
Aatomid ja molekulid
Lahused
Ионы
Знакомство с химией
Атомы и молекулы
Растворы
Ioonid
Tutvus keemiaga
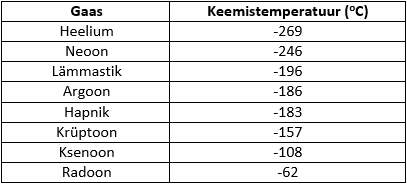
Õhs leiduvate peamiste gaaside keemistemperatuurid:
Väärisgaasidest kasutatakse kõige rohkem heeliumi, mis kasutatakse õhupallide ja õhulaevade täitmisel.
Heeliumi madala keemistemperatuuri tõttu (-269 oC) kasutatakse vedelat heeliumi külmutusseadmetes, kus on vaja väga madalat temperatuuri – näiteks CERN kiirendis ülijuhi tekitamiseks.
Heelium leiab rakendust ka sukeldumisel. Tuukrid kasutavad sukeldumisel hapniku segu heeliumiga (20% O2), et vähendada kessoontõve tekkimise võimalust.
Neooni kasutatakse reklaamvalgustites, kuna neoon lampides tekkiv punase kiirguse on hästi nähtav ka kaugelt. Neooni radioaktiivsust kasutatakse radioaktiivsust registreerivates müüteriistades, näiteks Geiger-Mülleri loendis.
Argooni kasutatakse peamiselt inertse keskkonna loomiseks erinevates keemilistes reaktsioonides. Samuti kasutatakse teda inertse keskkonna loomiseks hõõglampides ning säästupirnides
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!