3. Ainete füüsikalised omadused
MIKS ON VAJA TUNDA AINETE OMADUSI?
Ainele iseloomulikke tunnuseid nimetatakse aine omadusteks. Igal puhtal ainel on kindlad omadused, mis võimaldavad aineid üksteisest eristada. Aine omadused määravad vastava aine kasutusvõimalused. Omaduste muutumine viitab keemiliste reaktsioonide toimumisele ehk uute ainete tekkele. Selle märkamiseks ongi oluline õppida tundma ainete tähtsamaid tunnuseid.
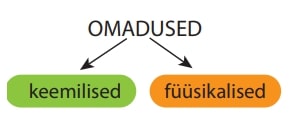
KUIDAS LIIGITATAKSE AINETE OMADUSI?
Keemilised omadused iseloomustavad aine reageerimisvõimet teiste ainetega. Keemiliste omaduste hulka kuuluvad näiteks aine võime põleda, reageerida veega jms.
Omadusi, mis pole seotud aine muundumisega teisteks aineteks, nimetatakse füüsikalisteks omadusteks. Olulisemad füüsikalised omadused on aine värvus, lõhn, sulamistemperatuur, keemistemperatuur, kõvadus, tugevus, elektrijuhtivus, soojusjuhtivus, lahustuvus erinevates lahustites, tihedus jt.
Kui aine värvuse ja lõhna saame määrata oma meeleorganite (silmade ja nina) abil, siis ülejäänud omaduste iseloomustamiseks tuleb kasutada katsete või mõõtmiste abi.
MIDA NÄITAVAD SULAMIS- JA KEEMISTEMPERATUUR?
Enamik aineid võib esineda kolmes olekus: tahkes, vedelas ja gaasilises. Erinevas olekus aine osakesed paiknevad erineva tihedusega, nende omavaheliste sidemete tugevus ning seetõttu ka liikumisvõime on erinevad.
Sulamistemperatuur on üleminekupiiriks aine tahke ja vedela oleku vahel, keemistemperatuur aga vedela ja gaasilise oleku vahel.
Aine oleku muutus ei tähenda, et aine muutub teiseks aineks. Näiteks nii jää, vesi kui ka veeaur koosnevad täpselt ühesugustest vee molekulidest.
Vee sulamistemperatuur on 0 °C ja keemistemperatuur 100 °C. Seega on vesi temperatuuril alla 0 °C tahkes olekus, vahemikus 0 °C kuni 100 °C vedelas olekus ja temperatuuril üle 100 °C gaasilises olekus.
Raua sulamistemperatuur on 1538 °C ja keemistemperatuur 2862 °C. Seega on raud temperatuuril alla 1538 °C tahkes olekus, vahemikus 1538 °C kuni 2862 °C vedelas olekus ja temperatuuril üle 2862 °C gaasilises olekus.
Hapniku sulamistemperatuur on –219 °C ja keemistemperatuur –183 °C. Seega on hapnik temperatuuril alla –219 °C tahkes olekus, vahemikus –219 °C kuni –183 °C vedelas olekus ja temperatuuril üle –183 °C gaasilises olekus.
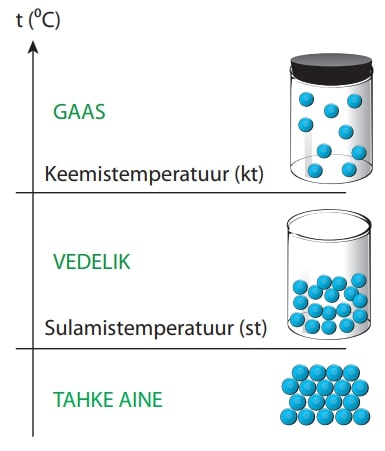
Aine olek ei sõltu ainult temperatuurist, vaid ka rõhust, sest aine keemistemperatuur sõltub rõhust. Näiteks süsihappegaas esineb tavarõhul sõltuvalt temperatuurist vaid gaasilises või tahkes olekus, kõrgel rõhul aga on olemas ka vedel süsihappegaas. Tahke aine (vahetut) üleminekut gaasiliseks nimetatakse sublimatsiooniks. Puhta aine sulamise või keemise vältel temperatuur ei muutu.
MILLE POOLEST ERINEVAD KÕVADUS JA TUGEVUS?
Kõvadus iseloomustab tahke aine vastupidavust kriimustamise või lõikamise suhtes, tugevus aga vastupidavust survele või painutamisele. Näiteks on klaas kõvem kui tavaline teras, sest klaasitükiga saab kriimustada terast (mitte aga vastupidi). Samas on terasest valmistatud esemed tugevamad kui klaasist valmistatud – kui klaasasjad purunevad välise jõu mõjul kergesti, siis terasesemed on vastupidavad.
Ainete suhtelist kõvadust iseloomustatakse Mohsi skaala abil, kus kõige pehmem on talk (kõvadus 1) ja kõige kõvem teemant (kõvadus 10).
MILLISED AINED ON HEAD ELEKTRI- JA SOOJUSJUHID?
Head elektri- ja soojusjuhid on metallid. Ülejäänud ained tavaliselt voolu ei juhi ja on halvad soojusjuhid. Elektrijuhtmed valmistatakse väga hea elektrijuhtivusega metallidest vasest või alumiiniumist. Kuna õhu koostises esinevad gaasid on halvad soojusjuhid, on rõivad seda soojemad, mida rohkem õhku riidekiudude vahele mahub. Eriti halva soojusjuhtivusega argooni kasutatakse pakettakende täitmisel.
Osade liitainete (nt soolade) lahused võivad juhtida elektrit. Seepärast tuleb hoiduda märgade kätega elektriseadmete puudutamisest, sest inimese nahal on erinevaid soolasid. Voolu juhib ka grafiit (mittemetalli süsiniku esinemisvorm).
KUIDAS LIIGITADA AINEID LAHUSTUVUSE JÄRGI VEES?
Täiesti lahustumatuid aineid pole olemas. Samas on paljude ainete lahustuvus vees niivõrd väike, et vaid üksikud aineosakesed liiguvad ainest vette. Selliseid aineid nimetatakse praktiliselt lahustumatuteks. Aineid, mida lahustub 100 g vees rohkem kui 1 g, peetakse vees hästi lahustuvateks. Ainete ligikaudset lahustuvust vees näitab lahustuvustabel (vt peatükist ABIMATERJALID JA VIITED).
KUIDAS VÕRRELDA AINETE „RASKUST“?
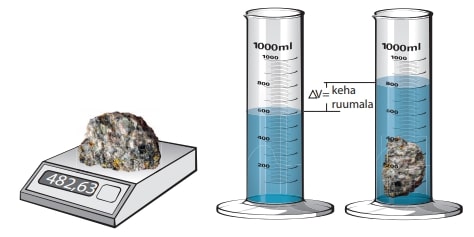
Kui soovime teada, kas aine on veest „kergem“ või „raskem“, piisab, kui ta panna vette: veest kergemad ained või nendest valmistatud kehad jäävad vee pinnale, raskemad vajuvad põhja. Alati aga ei saa aineid vette panna, ka on vaja sageli võrrelda omavahel hoopis erinevaid aineid. Siis tuleb appi võtta ainet iseloomustav arvuline suurus – tihedus.
Tihedus väljendab ühikulise ruumalaga ainekoguse massi.
Tavaliselt esitatakse keemiatundides tihedus grammides ühe kuupsentimeetri kohta, sest gramm ja kuupsentimeeter (ehk milliliiter) on sobivad ainekogused koolilaboris kasutamiseks. SI-süsteemis on aga tiheduse ühikuks kg/m³
Vee tihedust erinevates ühikutes on kasulik teada peast, sest see aitab vajadusel kergesti teisendada teiste ainete tihedusi.
Vee tihedus ρ($\ce{H_2O}$) = 1 g/cm³ = 1000 kg/m³ = 1 kg/dm³
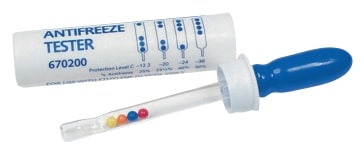
Auto jahutusvedeliku tihedus on seotud vedeliku külmumistemperatuuriga (õigem on küll öelda sulamistemperatuuriga). Mida rohkem värvilisi kuulikesi testris ujuma jääb, seda suurema tihedusega ja külmakindlam on vedelik.
Suure tihedusega on metallid, näiteks raua tihedus on 7,9 g/cm³ ja kullal 19,3 g/cm³ . Väikse tihedusega on gaasid, näiteks hapniku tihedus on 0,00143 g/cm³ .
Gaaside tihedus sõltub rõhust ja temperatuurist.
Tihedust arvutatakse järgmise valemi abil:
$\rho$ =m/V
$\rho$ [roo] – tihedus (g/cm3)
m – mass (g)
V – ruumala (cm3)
Kokkuvõte
- Ained erinevad omaduste poolest.
- Keemilised omadused iseloomustavad aine osalemist keemilistes reaktsioonides.
- Füüsikalised omadused pole seotud aine muundumisega: värvus, lõhn, sulamistemperatuur, keemistemperatuur, kõvadus, tugevus, elektrijuhtivus, soojusjuhtivus, lahustuvus erinevates lahustites, tihedus jt.
- Sulamistemperatuur on piiriks aine tahke ja vedela oleku vahel, keemistemperatuur aga vedela ja gaasilise oleku vahel.
- Tihedus väljendab ühikulise ruumalaga ainekoguse massi. Vee tihedus on 1 g/cm³ ehk 1000 kg/m³ ehk 1 kg/dm³.
SELLE ÕPPETÜKI LÄBIMISE JÄREL PEAKSID…
- oskama võrrelda ja liigitada aineid füüsikaliste omaduste põhjal (sulamis- ja keemistemperatuur, tihedus, kõvadus, elektrijuhtivus, värvus jms).