2.1. Aatomi ehitus
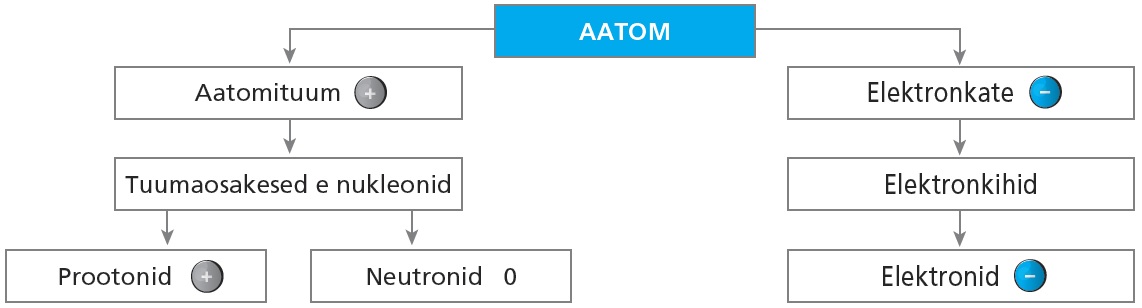
Aatom on laenguta aineosake, mis koosneb aatomituumast ja elektronkattest. Aatomituuma koostisse kuuluvad prootonid ja neutronid. Elektronkatte moodustavad elektronid.
Kuna osakeste massid ja laengud on väga väikesed, kasutatakse keemias nende esitamiseks spetsiaalseid suhtelisi ühikuid. Elementaarlaeng on väikseim vabadel osakestel esinev laeng $(1,6 \cdot 10^{-19} \textnormal{C})$. Aatommassiühik on $\frac{1}{12} \textnormal{C}$ aatomi massist. $1 \textnormal{amü} = 1,66 \cdot 10^{-24} \textnormal{g}$.
Aatommass $A_r$ on ühe aatomi mass aatommassiühikutes.
| Osake | Laeng (elementaarlaengutes) | Mass (aatommassiühikutes) |
|---|---|---|
| Prooton $(p)$ | +1 | 1 |
| Neutron $(n)$ | 0 | 1 |
| Elektron $(e^-)$ | -1 | 0,0005 |
Elektronkatte raadius ületab tuuma raadiust ~ 100 000 korda. Seega on aatomi mass koondunud suhteliselt väiksesse tuuma.
Isotoobid on elemendi teisendid, mille tuumas on erinev arv neutrone. Näiteks vesiniku isotoobid on kerge vesinik $\ce{^1_1H}$ („tavaline“ vesinik, mille tuumas on 1 p ja 0 n), raske vesinik $\ce{^1_2H}$ (tuumas 1 p ja 1 n) ja üliraske vesinik $\ce{^1_3H}$ (tuumas 1 p ja 2 n). Isotoopide tähistamisel toodud viisil näitab ülemine arv aatomi massiarvu ja alumine arv aatomnumbrit: $^A_Z E$ . Sageli kasutatakse ka varianti, kus elemendi nimetuse järele kirjutatakse tema massiarv, nt süsinik-14 tähistab süsiniku isotoopi massiarvuga 14.
