2.2. Keemiliste elementide omadused
Mida on võimalik välja lugeda perioodilisustabelist?
Perioodilisustabelis on keemilised elemendid reastatud tuumalaengu kasvu järjekorras. Elemendi asukoht perioodilisustabelis on otseselt määratud selle elemendi aatomiehitusega. Perioodilisustabel pole lihtsalt üks mugav võimalus elemente süstematiseerida.
Perioodilisustabel on ülevaatlik süsteem, mis peegeldab elementide aatomiehituse ja omaduste muutust tabeli rühmades ja perioodides. Seega võimaldab elemendi asukoht perioodilisustabelis teha olulisi järeldusi nii vastava elemendi lihtaine(te) kui ka keemiliste ühendite omaduste kohta.
AATOMIEHITUSE MUUTUS PERIOODILISUSTABELIS
Aatomiehituse muutus perioodides ja rühmades
Perioodid – horisontaalsed read perioodilisustabelis.
Perioodi numbri kasvades elektronkihtide arv aatomis kasvab. Sama perioodi elementidel
on elektronkihtide arv samasugune.
Perioodi number $(n)$ = elektronkihtide arv aatomis
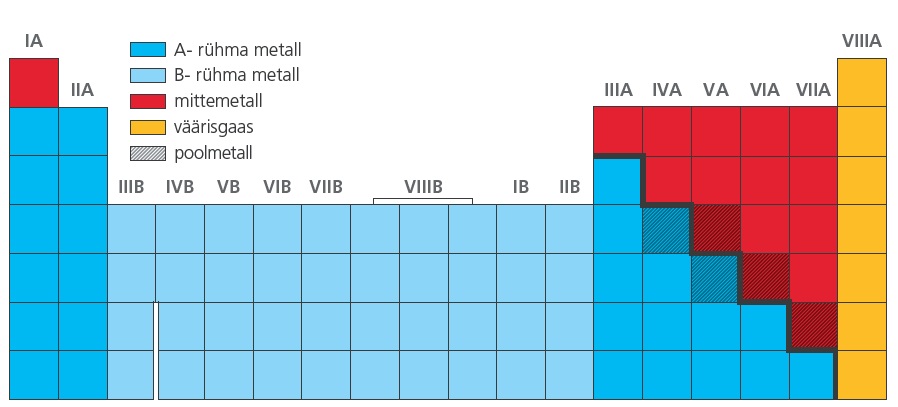
Rühmad – vertikaalsed tulbad perioodilisustabelis. Perioodilisustabeli rühmad jagunevad
A- ja B-rühmadeks. Tabelis on 8 A-rühma ja ka 8 B-rühma.
A-rühmades asuvad kõik lühikeste perioodide (1.–3. periood) elemendid ja nendele rühmades järgnevad elemendid. A-rühmade elementidel ehk nn tüüpilistel elementidel rühma numbri kasvades väliskihi elektronide arv kasvab. Sama rühma elementide väliskihi elektronide arv on samasugune.
A-rühmades rühma number =
väliskihi elektronide arv aatomis
B-rühmad tulevad juurde alates 4. perioodist. B-rühmade elementide ehk siirdeelementide aatomiehitus on mõnevõrra keerulisem kui tüüpilistel elementidel. Väliskihis on siirdeelementidel enamasti 2 elektroni, elektronid tulevad neile juurde eelviimasesse kihti.
Lantanoidid ja aktinoidid
Alates 6. perioodist elementide arv perioodis kasvab veel 14 elemendi võrra. Lisanduvad elemendid paigutatakse tavaliselt tabeli alla äärde eraldi ridadesse. Esimese lisarea moodustavad nn lantanoidid (nad järgnevad tabelis lantaanile), teise rea aktinoidid (järgnevad aktiiniumile).
AATOMIRAADIUSE MUUTUS
Keemiliste elementide omadused sõltuvad oluliselt nende aatomite suurusest, s.t aatomiraadiusest.
Rühmas (ülevalt alla) kasvab elektronkihtide arv aatomis ja seetõttu aatomiraadius $(r)$ suureneb.
Perioodis (vasakult paremale) jääb elektronkihtide arv aatomites samaks, kuid tuumalaeng kasvab. Seetõttu tuuma mõju aatomi väliskihi elektronidele tugevneb ja aatomiraadius $(r)$ väheneb.
Aatomiraadiuse (r) suurenemise suund perioodilisustabelis:
$\ce{v}$ $r$ (rühmas) $\qquad$ $\ce{<-}$ $r$ (perioodis)
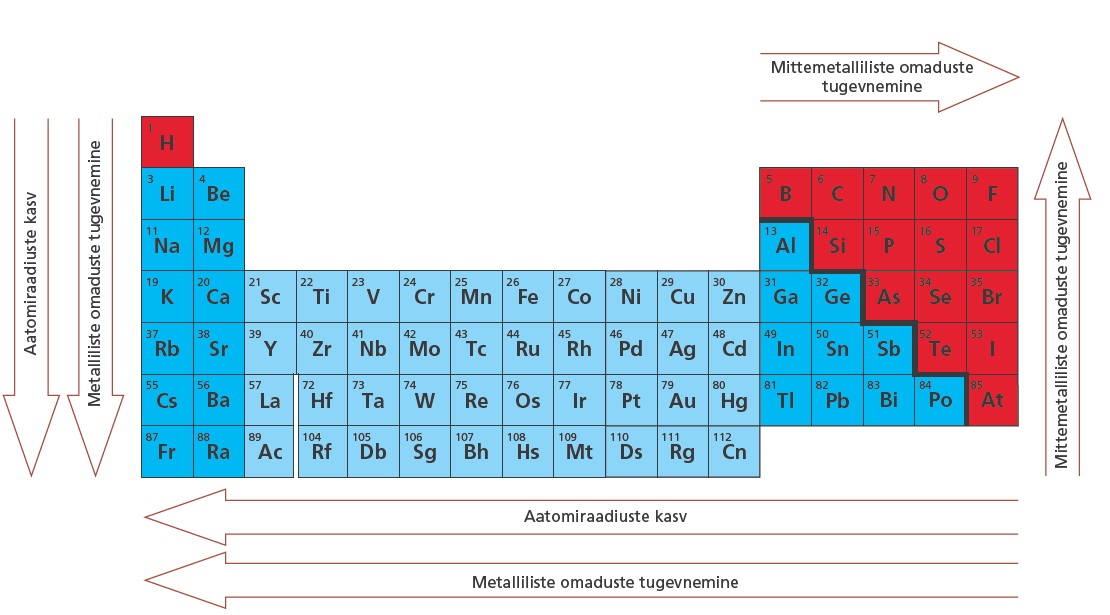
Kõige suurema aatomiraadiusega on tabeli vasakpoolses alumises osas asuvad leelismetallid ($\ce{K, Rb, Cs}$). Kõige väiksema aatomiraadiusega element on vesinik. Üsna väikese aatomiraadiusega on aga ka tabeli parempoolses ülemises osas asuvad elemendid ($\ce{He, O, F, Ne}$ jt).
Perioodilisustabelis aatomiraadius kasvab diagonaalsuunas ülevalt paremalt alla vasakule.

KEEMILISTE ELEMENTIDE METALLILISED JA MITTEMETALLILISED OMADUSED
Metallilised elemendid
Metallilised elemendid on lihtainena metallid. Metalliliste elementide aatomite väliskihis on suhteliselt vähe elektrone ja aatomiraadius on suhteliselt suur. Seetõttu on tuuma mõju väliskihi elektronidele küllaltki nõrk ja aatomid hoiavad väliskihi elektrone üsna nõrgalt kinni.
Keemilistes reaktsioonides metalliliste elementide aatomid alati loovutavad elektrone, muutudes vastavateks katioonideks. Elektrone loovutades käituvad aatomid redutseerijana – nende oksüdatsiooniaste kasvab.
$\ce{Ca – 2e^{-} -> Ca^{2+}}$
Mittemetallilised elemendid
Mittemetallilised elemendid on lihtainena mittemetallid. Mittemetalliliste elementide aatomiraadius on suhteliselt väike ja väliskihi elektronide arv suhteliselt suur. Seetõttu on tuuma mõju väliskihi elektronidele küllaltki suur ja aatomid hoiavad väliskihi elektrone üsna tugevasti kinni.
Keemilistes reaktsioonides saavad mittemetalliliste elementide aatomid elektrone siduda, muutudes vastavateks anioonideks. Elektrone sidudes käituvad aatomid oksüdeerijana – nende oksüdatsiooniaste kahaneb.
$\ce{S + 2e^{-} -> S^{2-}}$
Enamiku mittemetallide aatomid saavad aga elektrone ka loovutada, s.t käituda ka redutseerijana – nende oksüdatsiooniaste sel juhul kasvab.
Väävli käitumine oksüdeerijana või redutseerijana
Väävel on küllaltki aktiivne mittemetall. Oksüdeerijana käitub ta reageerides metallide või endast vähem aktiivsete mittemetallidega.
$\overset{\ce{0}}{\ce{S}} \overset{\ce{<- 2e^-}}{\ce{+}} \overset{\ce{0}}{\ce{Ca}} \ce{->} \overset{\textnormal{II}}{\ce{Ca}}\overset{\textnormal{-II}}{\ce{S}}$
Redutseerijana käitub väävel reageerides endast aktiivsemate mittemetallidega, näiteks hapnikuga.
$\overset{\ce{0}}{\ce{S}} \overset{\ce{4e^- ->}}{\ce{+}} \overset{\ce{0}}{\ce{O_2}} \ce{->} \overset{\ce{IV}}{\ce{S}} \overset{\ce{-II}}{\ce{O_2}}$
METALLILISUSE JA MITTEMETALLILISUSE MUUTUS PERIOODILISUSTABELIS
Element on seda metallilisem, mida kergemini tema aatomid loovutavad elektrone, ja seda mittemetallilisem, mida tugevamini tema aatomid seovad elektrone. Metalliliste ja mittemetalliliste omaduste muutus on seotud väliskihielektronide arvu ja aatomiraadiuse muutusega tabelis.
Metallilised omadused tugevnevad perioodilisustabelis rühmas ülevalt alla ja perioodis paremalt vasakule.
Kõige metallilisemad elemendid asuvad perioodilisustabeli vasakpoolses alumises osas. Kõige metallilisem on IA rühma element tseesium (frantsiumi kui väga ebapüsivat radioaktiivset elementi võib mitte arvestada).
Mittemetallilised omadused tugevnevad rühmas alt üles ja perioodis vasakult paremale.
Kõige mittemetallilisemad elemendid asuvad perioodilisustabeli parempoolses ülemises osas. Kõige mittemetallilisem on VIIA rühma element fluor $\ce{(F)}$.
Piir metalliliste ja mittemetalliliste elementide vahel
Metalliliste ja mittemetalliliste elementide vahele saab perioodilisustabelis tõmmata ligikaudse diagonaaljoone. Metallilised elemendid jäävad sellest vasakule ja allapoole, mittemetallilised paremale ja ülespoole.
Üleminek metallilistelt elementidelt mittemetallilistele ei toimu järsult, vaid küllaltki sujuvalt. Piirilähedases alas olevatel elementidel – nn poolmetallidel – esineb nii metallilisi kui ka mittemetallilisi omadusi. Ka lihtainena on nad omadustelt metallide ja mittemetallide vahepealsed. Olenevalt sellest, kas poolmetallil on ülekaalus metallilised või mittemetallilised omadused, liigitatakse ta metalliliseks (nt $\ce{Ge}$ ja $\ce{Sb}$) või mittemetalliliseks elemendiks (nt $\ce{As, Te}$). Samas on poolmetallid keemiliselt üsna väheaktiivsed, sest nii metallilised kui ka mittemetallilised omadused avalduvad neil küllaltki nõrgalt.
Väärisgaasid
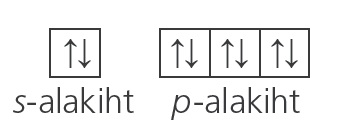
Enamiku väärisgaaside (peale heeliumi) välise elektronkihi ehitust kirjeldab alltoodud ruutskeem.
Nagu skeemilt näeme, on väärisgaaside aatomite väliselektronkiht täielikult täidetud – kõigil orbitaalidel asub elektronipaar. Seetõttu on väärisgaaside aatomid väga püsivad, neile pole iseloomulik ei elektronide loovutamine ega sidumine.
Lihtainena esinevad väärisgaasid üksikaatomite, mitte molekulidena, ja nad on keemiliselt väga inertsed, s.t väheaktiivsed. Heelium ja neoon ei moodusta üldse mingeid keemilisi ühendeid, teistel väärisgaasidel on saadud vaid väheseid ebapüsivaid ühendeid.
Kuna väärisgaasid praktiliselt ei avalda ei metallilisi ega mittemetallilisi omadusi, on otstarbekas vaadelda neid eraldi rühmana.
KOKKUVÕTE
- Perioodi number $(n)$ = elektronkihtide arv aatomis
Rühma number (A-rühmadel) = väliskihi elektronide arv aatomis - Elementide aatomiraadius suureneb:
- rühmas $\ce{v}$ (elektronkihtide arv aatomis kasvab)
- perioodis $\ce{<-}$ (perioodi alguses on tuumalaeng väiksem)
- Keemiline element on seda metallilisem, mida kergemini saavad tema aatomid elektrone loovutada.
Elektrone loovutades käituvad aatomid redutseerijana (oksüdatsiooniaste kasvab). - Elementide metallilisus tugevneb:
- rühmas $\ce{v}$ (aatomiraadius suureneb)
- perioodis $\ce{<-}$ (perioodi alguses on tuumalaeng väiksem, aatomiraadius suurem)
- Keemiline element on seda mittemetallilisem, mida paremini saavad tema aatomid elektrone siduda.
Elektrone sidudes käituvad aatomid oksüdeerijana (oksüdatsiooniaste väheneb).
Enamiku mittemetalliliste elementide aatomid saavad elektrone ka loovutada. - Elementide mittemetallilisus tugevneb:
- rühmas $\ce{^}$ (aatomiraadius väheneb)
- perioodis $\ce{->}$ (tuumalaeng kasvab, aatomiraadius väheneb)
KÜSIMUSED
- Mille järgi on keemilised elemendid reastatud perioodilisustabelis?
- Mille poolest on sama perioodi elemendid sarnased? Mis muutub elementide aatomiehituses perioodis vasakult paremale?
- Mille poolest on sama (A-)rühma elemendid sarnased? Mis muutub elementide aatomiehituses rühmas ülevalt alla?
- Iseloomustage järgmiste elementide aatomiehitust, nimetades elektronkihtide, väliskihi elektronide ja paardumata elektronide arvu:
- 3. perioodi VA rühma element;
- 4. perioodi IIIA rühma element.
- Määrake elemendi asukoht tabelis (perioodi ja rühma number), kui selle elemendi aatomis on:
- 5 elektronkihti, 8 väliskihi elektroni;
- 3 elektronkihti, 4 väliskihi elektroni.
- Kuidas ja miks muutub aatomiraadius perioodilisustabeli rühmades ja perioodides?
- Mille põhjal liigitatakse elemente metallilisteks ja mittemetallilisteks?
- Kuidas ja miks muutuvad elementide metallilised ja mittemetallilised omadused perioodilisustabelis (piki rühma ja piki perioodi)?
- Miks on metallilistel elementidel ühendites ainult positiivsed oksüdatsiooniastmed?
- Miks metallid saavad käituda keemilistes reaktsioonides ainult redutseerijana, mittemetallid aga enamasti nii oksüdeerija kui ka redutseerijana?
- Milliseid elemente nimetatakse poolmetallideks? Kus nad asuvad perioodilisustabelis?
- Millised alltoodud elementidest on metallilised? Reastage nad metallilisuse nõrgenemise järjekorras (alustades kõige metallilisemast elemendist).
$\ce{Al, Ne, Mg, K, N, Br, Si, Ca, Cl, Cs}$ - Millised alltoodud elementidest on mittemetallilised? Reastage nad mittemetallilisuse nõrgenemise järjekorras (alustades kõige mittemetallilisemast elemendist).
$\ce{Sn, As, Ar, Cl, Li, S, Ca, F, P, Sr}$ - Milliste alltoodud lihtainete suhtes käitub väävel oksüdeerijana, milliste suhtes redutseerijana?
$\ce{O_2, Mg, Fe, Li, He, H_2, Cl_2, Si, Al, P}$