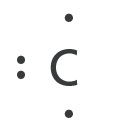2.1. Tänapäevane ettekujutus aatomiehitusest
Miks on vaja tunda aatomiehitust?
Keemiliste elementide omadused tulenevad otseselt nende aatomite ehitusest (elektronstruktuurist ja aatomiraadiusest). Elemendi aatomiehituse põhjal saame teha järeldusi nii vastava elemendi kui ka tema poolt moodustatud ainete omaduste kohta. Seega võimaldab aatomiehituse tundmine teha järeldusi tohutult suures ainete mitmekesisuses, ilma et peaksime iga aine kohta eraldi andmeid koguma ja meelde jätma.
AATOMIEHITUSE MUDELID
Tänapäeva keerulised mikroskoobid võimaldavad saada küll kujutisi üksikutest aatomitest, kuid aatomite sisemist ehitust nad ei peegelda. Seepärast on aatomiehitust võimalik selgitada vaid mitmesuguste kaudsete uuringutega. Ettekujutusi aatomite struktuuri kohta kirjeldatakse vastavate teoreetiliste mudelite abil. Loodud mudelite vastavust tegelikkusele saab hinnata selle järgi, kui hästi langevad nende põhjal tehtud arvutused kokku eksperimentaalsete andmetega.

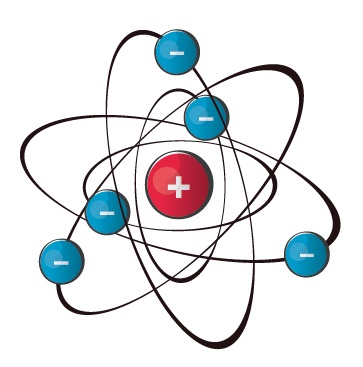
Aatomiehituse Bohri mudel
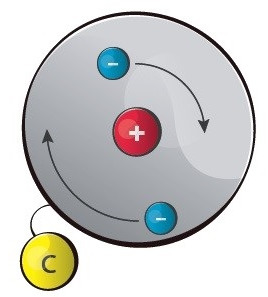
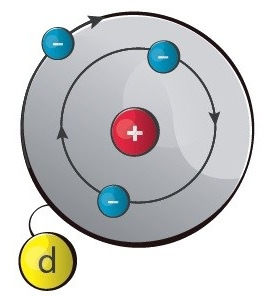
Selle aatomiehituse mudeli esitas taani teadlane Niels Bohr 1913. a, arendades edasi inglise teadlase sir Ernest Rutherfordi loodud nn planetaarset mudelit. Bohri mudeli eeliseks on tema lihtsus ja ülevaatlikkus, kuid keerulisemate aatomite kirjeldamisel jääb ta siiski üsna ebatäpseks. Elektronide liikumine aatomis on tegelikult palju keerulisem, kui on arvestatud Bohri mudelis.
Bohri mudeli põhiseisukohad
Elektronid tiirlevad ümber aatomituuma ringikujulistel,
kindla raadiusega orbiitidel. Elektronkihid täituvad elektronidega energia kasvu järjekorras, alates esimesest, tuumale kõige lähemast (kõige madalama energiaga) elektronkihist.
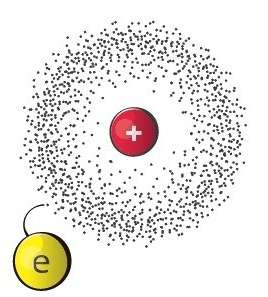
TÄNAPÄEVANE (KVANTMEHAANILINE) AATOMIEHITUSE MUDEL
Tänapäevase ehk kvantmehaanilise aatomimudeli esitasid austria teadlane E. Schrödinger ja saksa teadlane W. Heisenberg 1923. a. See mudel põhineb ettekujutusel elektroni lainelistest omadustest. Elektroni liikumise täpset teed aatomis polegi võimalik määrata.
Ülikiire liikumise tõttu elektronid nagu jaotuksid mingis ruumiosas ühtlaselt laiali. Seda võib võrrelda näiteks helikopteri tiiviku liikumisega. Tiiviku kiirel pöörlemisel näib, nagu oleks tiivik ühtlaselt laiali määritud, moodustades ketta. Samuti on alas, kus elektron peamiselt liigub, elektroni negatiivne laeng „laiali määritud“, moodustades nn elektronpilve.
Selles piirkonnas, kus elektron liigub kõige sagedamini, on ka elektronpilve tihedus kõige suurem, s.t elektroni leidumise tõenäosus on seal väga suur.

Aatomorbitaal
Seda ruumiosa aatomis, kus elektron peamiselt liigub, s.t kus elektroni leidumise tõenäosus
on suur, nimetatakse orbitaaliks. Elektroni liikumisel tekkiva elektronpilve kuju on seega määratud vastava orbitaali kujuga. Osa orbitaale on kerakujulised, teised on keerukama kujuga.
Ühele orbitaalile mahub kuni 2 elektroni. Nad moodustavad nn elektronipaari. Erinevates elektronkihtides olevate orbitaalide arv määrab, mitu elektroni vastavasse kihti mahub. Esimeses kihis on 1 orbitaal, sinna mahub vaid 2 elektroni. Teises elektronkihis on kokku 4 orbitaali, sinna mahub 8 elektroni jne. Aatomite väliskihis saavad elektronid üldreeglina olla ainult neljal orbitaalil, seega mahutab väliskiht kuni 8 elektroni.
Orbitaalide täitumine elektronidega
Väliskihi elektronid jaotuvad omakorda kahte alakihti – esimeses alakihis ehk s-alakihis on 1 orbitaal, teises alakihis ehk p-alakihis 3 orbitaali.
Elektronide paiknemist aatomi väliskihi orbitaalidel saab kujutada nn ruutskeemina. Orbitaale märgitakse selles väikeste ruutudega. Ruudukeste arv näitab, mitu orbitaali vastavas alakihis on.
Elektrone tähistatakse ruutskeemides püstnoolekestega. Kui orbitaalil asub üksik (paardumata) elektron, märgitakse üks nooleke. Kui orbitaalil asub elektronipaar, märgitakse kaks vastassuunalist noolekest. Tühja orbitaali tähis on tühi ruuduke.
Kõigepealt täidavad elektronid s-alakihi orbitaali (selle energia on mõnevõrra väiksem), järgmised elektronid lähevad p-alakihi orbitaalidele. Kuna p-orbitaalid on võrdse energiaga, jagunevad elektronid nende vahel algul ükshaaval. Kui elektrone on rohkem, siis täidavad nad orbitaale ka kahekaupa.
Elektronide magnetilised omadused
Elektronidel on lisaks negatiivsele laengule ka magnetilised omadused. Elektronipaari saavad moodustada vaid vastassuunalise magnetväljaga elektronid (tähistame vastassuunaliste noolekestega). Vastassuunaline magnetväli vähendab nende omavahelist tõukumist negatiivse laengu tõttu. Sama alakihi erinevatel orbitaalidel olevate paardumata elektronide magnetväljad
on aga samasuunalised (märgime samasuunaliste noolekestega).
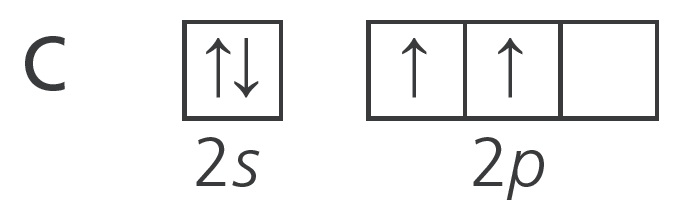
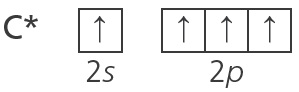
Süsiniku aatomi ruutskeem
Süsiniku ($\ce{Z = 6}$) aatomi välises elektronkihis on 6 elektroni. Süsiniku ruutskeem on
järgmine:
Skeemilt näeme, et süsiniku aatomi väliskihis on 1 elektronipaar, 2 paardumata elektroni ja 1 tühi orbitaal.
Selline on elektronide paigutus süsiniku aatomis nn põhiolekus. Kui aatom saab energiat juurde (nt keemiliste sidemete moodustamisel), saab üks s-elektron ergastuda ja minna vabale p-orbitaalile. Siis jaotuvad süsiniku kõik väliskihi elektronid orbitaalidele ükshaaval. Ergastunud süsiniku aatomi (tähistatakse tärnikesega) ruutskeem on järgmine:
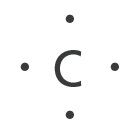
Täppvalemid
Elektronide jaotust aatomi väliskihis saab väljendada ka lihtsamalt, nn täppvalemitega. Väliskihi neljal orbitaalil paiknevad elektrone kujutatakse täpikestena elemendi sümboli neljal küljel. Süsiniku aatomi täppvalemid on järgmised:
Elementide elektronstruktuuri põhjalikum käsitlus on toodud Lisalugemises (vt ptk 6.2).
KOKKUVÕTE
- Orbitaal – ruumiosa, kus elektroni leidumise tõenäosus ehk elektronpilve tihedus on väga suur. Ühel orbitaalil saab olla kuni 2 elektroni (elektronipaar).
- Aatomi väline elektronkiht koosneb kahest alakihist:
- alakiht, milles on 1 orbitaal;
- alakiht, milles on 3 orbitaali.
- Orbitaalide täitumist elektronidega kirjeldab ruutskeem (orbitaale tähistavad ruudud, elektrone noolekesed). Orbitaalid täituvad elektronidega energia kasvu järjekorras – enne s-orbitaal, seejärel p-orbitaalid. p-alakihi orbitaalidele lähevad elektronid algul ükshaaval.
- Täiendava energia saamisel võib elektron ergastuda, s.t minna kõrgema energiaga orbitaalile.
KÜSIMUSED
- Kuidas tekib elektronpilv? Mida näitab elektronpilve tihedus?
- Mis on orbitaal?
- Miks saab aatomi väliskihis olla vaid kuni 8 elektroni?
- Miks täidavad elektronid kõigepealt väliskihi s-orbitaali ja alles seejärel lähevad
- p-orbitaalidele?
- Mis on elektronipaar? Kuidas teda tähistatakse?
- Selgitage hapniku aatomi väliskihi ehitust ruutskeemi abil.
- Koostage järgmiste elementide elektronskeemid:
- Z = 9;
- Z = 13;
- Z = 16;
- Z = 18.
Kujutage vastavate aatomite väliskihi ehitust ruutskeemidega.
Mitu elektronipaari ja paardumata elektroni on nende aatomite väliskihis?
- Mis toimub süsiniku aatomi ergastumisel?