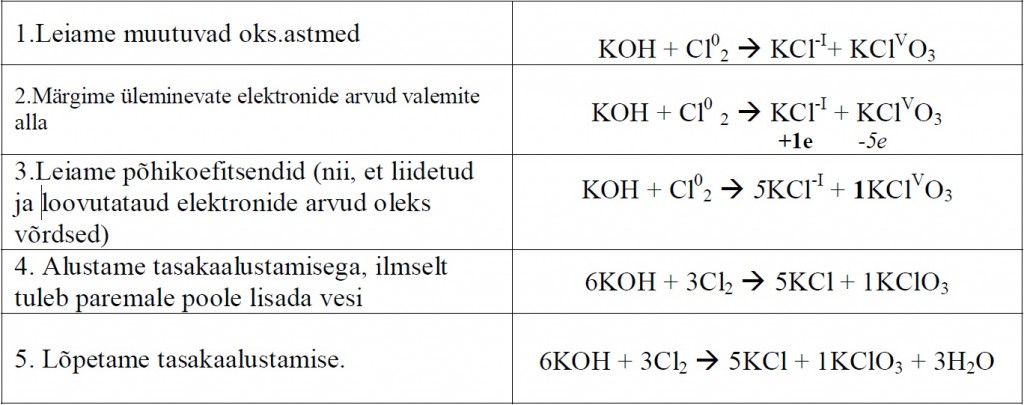
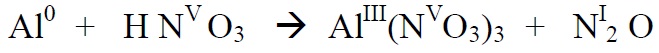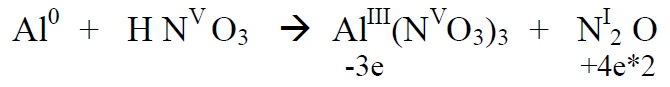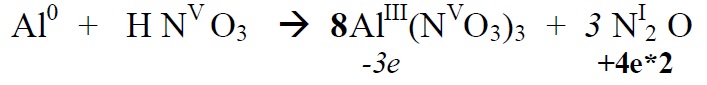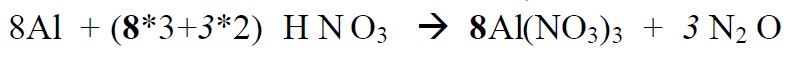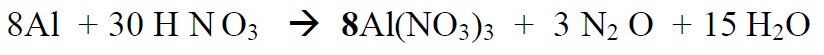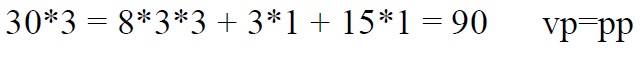Redoksreaktsioonide tasakaalustamine
Redoksreaktsiooni käigus muutub mõne elemendi oks.aste. Tasakaalustamine põhineb
laengu jäävuse seadusel, st.liidetud ja loovutatud elektronide arvud peavad olema võrdsed.
Tasakaalustame etapphaaval järgmise redoksvõrrandi:
– Põhimõtteliselt on ükskõik, kas alustada taskaalustamist vasakult või paremalt.
Mugavam on alustada sealt, kus mingi element on erineva oks.astmega ühendite
koostises.
– Kui elemendi aatomeid on mitu, tuleb seda loomulikult üleminevate elektronide
arvu leidmisel arvestada
Sulle võivad huvi pakkuda need õppematerjalid:
Знакомство с химией
Ионы
Ioonid
Tutvus keemiaga
Aatomid ja molekulid
Oksüdatsiooniaste
Растворы
Lahused
Атомы и молекулы
*Alustame paremalt, sest seal on lämmastik kahes erinevas oks.astmes. Üleminevate
elektronide arvu leidmisel arvestame ka seda, et N2O molekulis on kaks N aatomit ja
2 aatomi oks.astme muutmiseks viiest – üheni on vaja on (5-1)*2 elektroni
*Leiame põhikoefitsendid
*Alustame tasakaalustamist nendest elementidest, mis muudavad oks.astet ( Al , N)
*Lõpetame tasakaalustamise
*Kontrollime hapniku järgi
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!