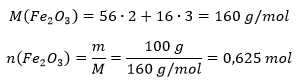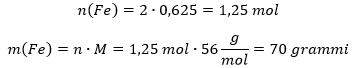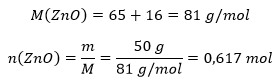Reaktsiooni saagis
Sünteesides keemilisi aineid, esinevad reaktsioonis alati kaod – reaktsioon ei kulge lõpuni, osa aineid jääb nõude külge jne. Seda, kui palju ainet saadakse reaktsiooni käigus kätte võrreldes teoreetilise kogusega näitab reaktsiooni saagis. Enamasti väljendatakse seda protsentides.
Arvutusülesanne 1: Milline on reaktsiooni saagis, kui 100 grammi raud(III)oksiidi redutseerimisel saadi 50 grammi puhast rauda?
Sulle võivad huvi pakkuda need õppematerjalid:
Растворы
Атомы и молекулы
Ioonid
Ионы
Aatomid ja molekulid
Lahused
Tutvus keemiaga
Oksüdatsiooniaste
Знакомство с химией
Lahendus: Kirjutame välja reaktsioonivõrrandi. Antud ülesande korral pole oluline, millist redutseerijat kasutati, seega kirjutame välja võrrandi näiteks vesinikuga.
Fe2O3 + 3H2 = 2Fe + 3H2O
Leiame, mitu mooli raud(III)oksiidi alguses oli:
Vastavalt reaktsioonivõrrandile, tekib rauda kaks korda rohkem (raua ees on kordaja kaks ning raud(III)oksiidi ees üks). Võrrandi järgi tekkinud raua mass on seega:
Teoreetiline kogus rauda, mis saaks 100 grammist raud(III)oksiidist tekkida on 70 grammi. Tegelikult saadi 50 grammi, seega on reaktsiooni saagis p:
Vastus: Reaktsioonisaagis on 71,4%
Arvutusülesanne 2: Mitu grammi tsinki saadakse 50 grammi tsinkoksiidi redutseerimisel süsinikuga, kui reaktsiooni saagis on 80%?
Lahendus: Kirjutame reaktsioonivõrrandi
2ZnO + C = 2Zn + CO2
Leiame tsinkoksiidi hulga:
Võrrandi järgi tekib tsinki sama palju (kordajad on tsingi ja tsinkoksiidi ees samad), seega oleks tekkinud tsingi mass:
See on teoreetiline kogus, kuna saagis on 80%, siis tegelikult saadud tsingi mass on:
Vastus: Tsinki saadi reaktsiooni käigus 32,1 grammi.
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!