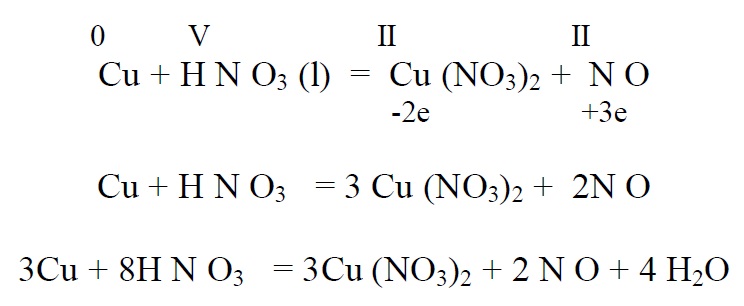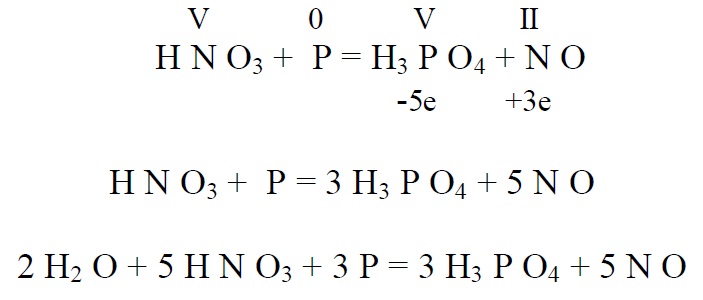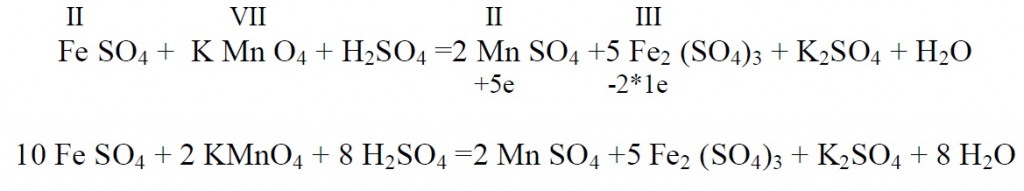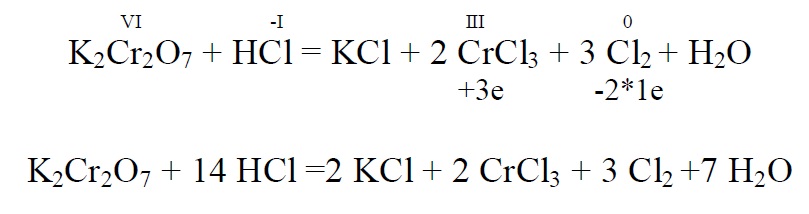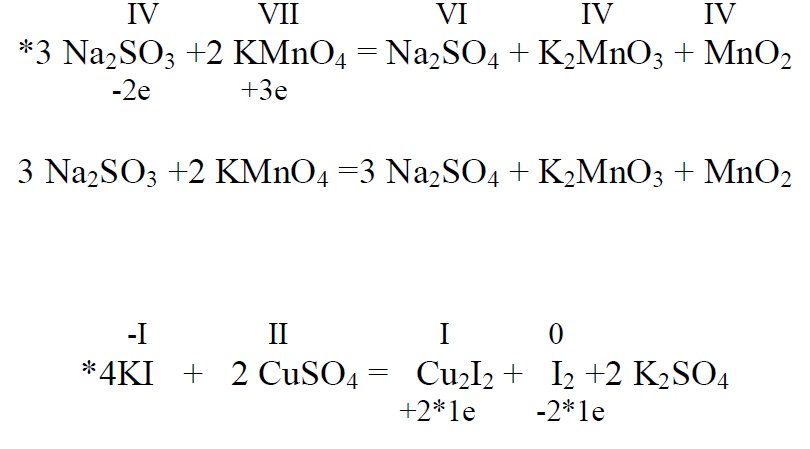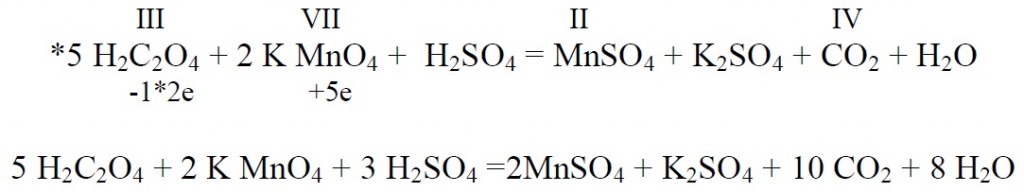Olulisemad oksüdeerijad
Üldiselt on tegemist ühenditega, milles mõne elemendi oks.aste on tavalisest kõrgem. Nitraadid ; eelkõige lämmastikhape
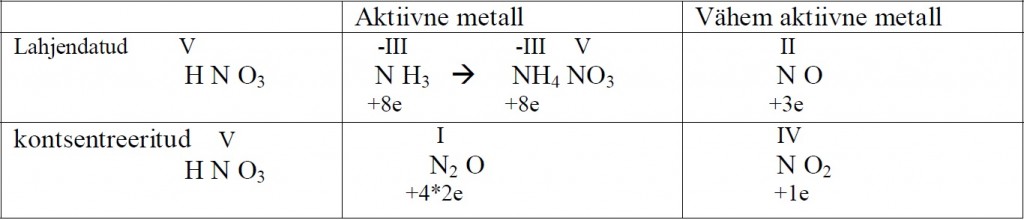
Lämmastikhappe reageerimisel metallidega tuleb arvestada, et nitraatioon
on tugevam oksüdeerija, kui vesinikioon ja seetõttu lämmastikhappe ja metalli vahelisel reaktsioonil vesinikku ei eraldu. Nitraatioon redutseerub mingiks madalamaks lämmastikuühendiks. Enamasti tekib mitu redutseerumissaadust ja võrrand on seega pigem kokkuleppe küsimus. Ligikaudu võib redutseerumissaadusi leida järgnevast tabelist. Viimane aktiivne metall pingereas on umbes tsink.
Sulle võivad huvi pakkuda need õppematerjalid:
Знакомство с химией
Ионы
Ioonid
Tutvus keemiaga
Aatomid ja molekulid
Oksüdatsiooniaste
Растворы
Lahused
Атомы и молекулы
Näiteks:
Lämmastikhape võib reageerida, ka mittemetallidega oksüdeerides neid hapeteks (kui hape on ebapüsiv, tekib oksiid)
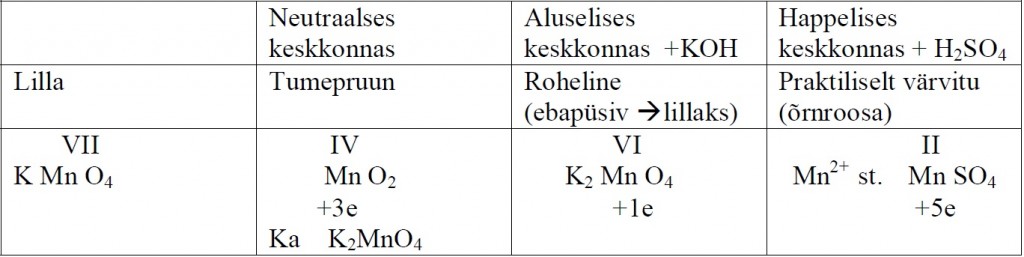
Kaaliumpermanganaat
Näiteks
Kaaliumdikromaat – K2 CrVI2 O7 oranz kristalne aine, redutseerub Cr(III) – ni. Happelises keskkonnas tekib vastav sool ( Cr2(SO4)3 …..) , aluselises keskkonnas tekib kromit Na[Cr(OH)4] ehk lihtsustatult NaCrO2
Tähtsamad redutseerijad on metallid, vesinik , sulfiidid, sulfitid, jodiidid aldehüüdid, oblikhape(H2C2O4 ) ……
Vask(I)jodiidi valemit kirjutatakse enamasti ![]() vahel ka
vahel ka ![]() ja lihtsustatult
ja lihtsustatult ![]()
Tegelikult ei saa oksüdeerijatest ja redutseerijatest eraldi rääkida, sest millegi redutseerumisega kaasneb alati ka millegi oksüdeerumine.
Ia rühma metallid – leelismetallid
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!