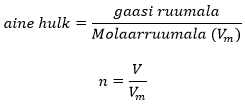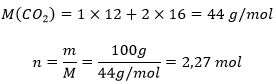Molaarruumala
Mool on ainehulga ühik ning ühes moolis on alati 6,02•1023 aineosakest. Gaasilistes ainetes on aineosakesed ühtlaselt jaotunud ning seetõttu on samal temperatuuril kindlas ruumalaühikus alati sama arv aineosakesi. Gaaside korral mõistlik moolarvutustes kasutada molaarruumala (tähistatakse Vm). Molaarruumala näitab, mitu liitrit gaasi sisaldab 1 mool ainet ning see on kõikide gaaside jaoks sama suurus.
Sulle võivad huvi pakkuda need õppematerjalid:
Lahused
Oksüdatsiooniaste
Ионы
Атомы и молекулы
Знакомство с химией
Ioonid
Tutvus keemiaga
Aatomid ja molekulid
Растворы
Molaarruumala sõltub gaasi temperatuurist ning rõhust. Standardtingimustel (temperatuur 0 oC ning rõhk 1 atm) on kõikide gaaside molaarruumalaks Vm = 22,4 l/mol.
Molaarruumala kasutades saab gaaside ainehulka (moole) leida järgmiselt:
Teades gaasi moole on kergesti võimalik arvutada ka gaasi massi kasutades molaarmassi (M).
Näidisülesanne: Kui suur on 100 grammi süsihappegaasi ruumala standardtingimustel?
Lahendus:
Leiame kõigepealt süsihappegaasi (CO2) molaarruumala ning moolid:
Teades süsihappegaasi moole, saame leida gaasi ruumala kasutades molaarruumala:
Vastus: 100 grammi süsihappegaasi ruumala on 50,8 liitrit.
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!