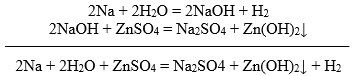Metallide omadused
Enamus metallide omadusi on seotud metallide ühiste elektronidega, mis saavad vabalt liikuda metalliaatomite vahel.
Füüsikalised omadused
Metalle iseloomustavad järgmised ühised omadused
- Metalne läige
- Hõbevalge värvus (v.a kuld, vask ja tseesium, mis on kuldsed)
- Head soojus- ja elektrojuhid
- Plastilised
Metallide tihedus võib olla väga erinev (0,5 g/cm3 kuni 20 g/cm3). Kõige kergem metall on liitium (0,5 g/cm3), mis on kergem kui vesi. Kõige raskemate metallide hulka kuuluvad osmium, iriidium ja kuld.
Sulle võivad huvi pakkuda need õppematerjalid:
Растворы
Атомы и молекулы
Ioonid
Ионы
Aatomid ja molekulid
Lahused
Tutvus keemiaga
Oksüdatsiooniaste
Знакомство с химией
Enamasti on metallid suhteliselt kõrge sulamistemperatuuriga. Toatemperatuuril on vedelas olekus ainult elavhõbe, kuid alla 40 oC jääb sulamistemperatuur veel tseesiumil, galliumil ja rubiidiumil. Kõige kõrgem sulamistemperatuur on volframil (3422 oC).
Osadele metallidele on iseloomulikud ka magnetilised omadused. Magnetiliste omadustega on kõige tuntum metall, raud. Kuid lisaks rauale on magnetiliste omadustega veel koobalt nikkel ning gadoliinium.
Keemilised omadused
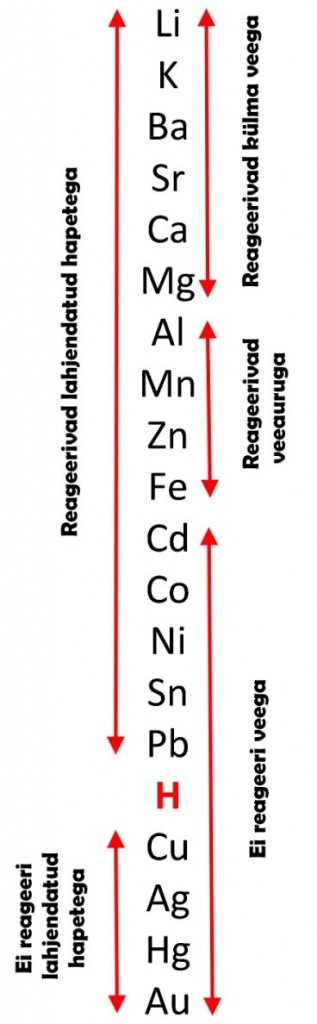
Metallide keemiliste omaduste jaoks on vaja teada metallide aktiivsust. Metallide pingereas (vt joonis) on metallid paigutatud ritta aktiivsuse järgi. Kasutades aktiivsuse rida on kerge meelde jätta, millised metallid reageerivad veega, vee auruga, hapetega ning mis sooladega metallid reageerida võivad.
Keemilistes reaktsioonides käituvad kõik metallid (lihtainena) redutseerijatena – metallid loovutavad elektrone.
Metallide reageerimine lihtainetega. Metallid võivad reageerida erinevate lihtainetega. Klooriga reageerivad kõik metallid
2Fe + 3Cl2 = 2FeCl3
Cu + Cl2 = CuCl2
Väävliga reageerivad samuti enamus metalle, välja arvatud kuld, mis on vähe aktiivne metall.
2Al + 3S = Al2S3
Enamus metalle ka põleb hapnikus, moodustades vastava oksiidi.
2Ca + O2 = 2CaO
Metallid võivad reageerida juba õhuhapniku toimel, tekitades metalli pinnale oksiidi kihi. Reageerimisel õhuhapnikuga võivad olla nii head kui halvad tagajärjed. Näiteks alumiiniumi pinnale tekib alumiiniumoksiidi kiht, mis kaitseb alumiiniumit edasise oksüdeerumise eest. Kuid raua reageerimisel hapnikuga tekib raua pinnale samuti oksiidi kiht (Fe2O3), kuid see ei kaitse rauda edasise oksüdeerumise eest, vaid rauddetail võib õhu käes seistes täielikult hävida (raua roostetamine).
Metallide reageerimine veega. Veega reageerivad ainult väga aktiivsed metallid – metallide pingereas metallid kuni magneesiumini (vt joonis). Metallide reageerimisel veega eraldub vesinik.
2Na + 2H2O = 2NaOH + H2
Veeauruga võivad reageerida ka keskmise aktiivsusega metallid – metallide pingereas metallid kuni rauani.
3Fe + 4H2O = Fe3O4 + 4H2
Metallide reageerimine hapetega. Lahjendatud hapetega reageerivad kõik metallid, mis asuvad metallide pingereas vesinikust vasakul ning tõrjuvad happest välja vesiniku.
Zn + H2SO4 = ZnSO4 + H2
Erandiks on lämmastikhape, mis metallidega küll reageerib, kuid vesinikku välja ei tõrju. Metalli reageerimisel lämmastikhappega tekib mingi lämmastikoksiid, metalli sool ja vesi.
Metallide reageerimine sooladega. Aktiivne metall tõrjub vähemaktiivse metalli tema soolast välja. Metallide aktiivsusi saab vaadata pingereast. Näiteks tsink tõrjub välja vase vasksulfaadi lahusest, kuid raud tsinksulfaadiga ei reageeri (raud on vähemaktiivsem kui tsink).
Zn + CuSO4 = Cu + ZnSO4
Fe + ZnSO4 = reaktsiooni ei toimu
Väga aktiivsed metallid, need mis reageerivad veega, samuti ei tõrju teist metalli soola lahusest välja. Põhjus on selles, et aktiivne metall reageerib kõigepealt veega mitte soolaga. Aktiivse metalli reageerimisel soola lahusega toimub kaks reaktsiooni. Metall reageerib kõigepealt veega ning tekkinud hüdroksiid reageerib soola lahusega. Näiteks, kui panna naatrium reageerima tsinksulfaadiga, toimuvad järgmised reaktsioonid.
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!