KEEMILISE REAKTSIOONI KIIRUS
Keemilise reaktsiooni kiiruse all mõeldakse seda, kui kiiresti muutub aine kontsentratsioon. Teisiti öeldes, mõeldakse seda, et kui palju tekib uut ainet (või kui palju lähteainet ära reageerib) teatud aja jooksul.
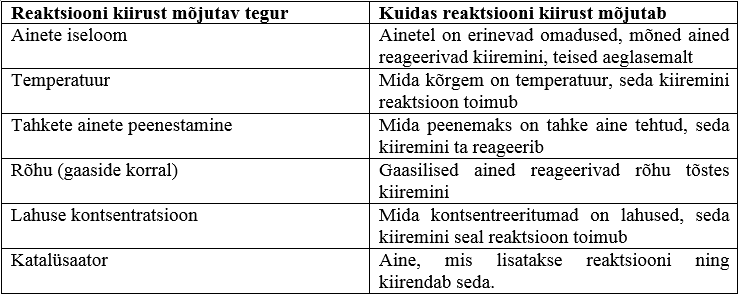
Keemilise reaktsiooni kiirus sõltub mitmetest asjaoludest. Peamiselt sõltub ta reageerivate ainete iseloomust. Näiteks raud roostetab õhu käes suhteliselt aeglaselt, kuid alumiinium kattub oksiidikihiga palju kiiremini.
Kui reaktsioonist võtavad osa tahked ained, siis sõltub reaktsiooni kiirus ka sellest, kui suured on tahke aine tükid. Mida peenestatumad on ained, seda kiiremini nad reageerivad.
Sulle võivad huvi pakkuda need õppematerjalid:
Aatomid ja molekulid
Lahused
Растворы
Знакомство с химией
Oksüdatsiooniaste
Tutvus keemiaga
Ионы
Ioonid
Атомы и молекулы
Samuti sõltub reaktsiooni kiirus temperatuurist. Paljude keemiliste reaktsioonide korral reaktsiooni kiirus temperatuuri tõusuga kasvab.
Gaasiliste ainete korral mõjutab reaktsiooni kiirust ka rõhk. Mida suurema rõhu all gaasilised ained reageerima pannakse, seda kiiremini reaktsioon toimub. Kiirus suureneb seetõttu, et rõhu all surutakse gaasi osakesed üksteisele lähemale ning seetõttu toimub rohkem põrkeid aineosakeste vahel, mis viibki reaktsiooni kiirema toimumiseni.
Lahuste korral mõjutab reaktsiooni kiirust ka lahuse kontsentratsioon. Mida kontsentreeritumad on lahused (mida rohkem lahutunud ained lahuses leidub), seda kiiremini reaktsioon toimub.
Reaktsiooni kiirust mõjutab ka katalüsaator. Katalüsaator on aine, mis lisatakse reageerimise juurde. Katalüsaator tõstab reaktsiooni kiirust, kuid ei mõjuta seda, mis ained reaktsioonis tekivad.
Loe lisaks:
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!