Korrosioon
Korrosiooniks nimetatakse metallide ja nende sulamite hävimist väliskeskkonna toimel. Eristatakse kahte liiki korrosiooni – keemilist ja elektrokeemilist korrosiooni.
Keemiline korrosioon on metallide hävimine gaaside toimel või lahustes, kus ei ole elektrolüüte. Keemiline korrosiooni tulemusena kattub näiteks õhu käes, vihma eest kaitstud, rauddetail rooste (raud(III)oksiidi) kihiga
Sulle võivad huvi pakkuda need õppematerjalid:
Lahused
Ионы
Ioonid
Растворы
Oksüdatsiooniaste
Aatomid ja molekulid
Атомы и молекулы
Знакомство с химией
Tutvus keemiaga
4Fe + 3O2 = 2Fe2O3
Elektrokeemiline korrosioon leiab aset elektrolüütide lahustes. Peamiselt leiab elektrokeemiline korrosioon aset niiskes õhus. Vesi, kus on lahustunud süsihappegaas on elektrolüüdi lahus. Peamine metall, mis elektrokeemiliselt hävib on raud. Kõigepealt toimub lahuses raua oksüdeerumine hapniku toimiel ja lahusesse lähevad raud(II)ioonid ning hapnikust tekivad hüdroksiidioonid.
Fe = Fe2+ + 2e–
O2 + 2H2O + 4e– = 4OH–
Nende reaktsioonide tulemusena tekib raua pinnale raud(II)hüdroksiidi sade, mis hapniku toimel oksüdeerub edasi raud(III)hüdroksiidiks. Tekkinud raud(III)hüdroksiid esineb raua pinnal peamiselt raud(III)oksiidina (raua roostena), mis on seotud mõne vee molekuliga.
Elektrokeemiline korrosioon põhjustab palju suuremad kahju kui keemiline korrosioon, kuna elektrokeemilise korrosiooni korral toimub metalli hävimine kordades kiiremini kui keemilise korrosiooni korral. See on ka põhjuseks, miks autod talvel rohkem roostetavad – soolane lumi tagab soodsa pinnase elektrokeemilise korrosiooni toimumiseks.
Korrosiooni kaitse seisneb selles, et aeglustatakse või peatatakse metalli hävimine. Kõige lihtsam võimalus on metall üle värvida või lakkida. Sellisel juhul ei ole metall enam kontaktis väliskeskkonnaga. Metalli on kaitstud seni, kuni kaitsekiht on kahjustamata. Kui kaitsekihti kriimustada, siis pääsevad oksüdeerijad metallini ning metall hakkab kriimustatud kohast hävinema.
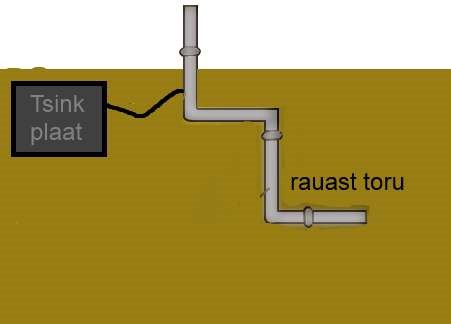
Metalli kaitsmiseks korrosiooni eest võib metalli külge kinnitada aktiivsema metalli tükid (enamasti kastutakse tsink plaate). Sellisel juhul korrodeerub esimesena aktiivsem metall ning teine metall on korrosiooni eest kaitstud. Näiteks katistakse nii maa sees olevaid raudtorusid, mis on ühenduses tsinkplaatidega. Metalli kaitset aktiivsema metalli ühendamisega põhimetallist eseme külge nimetatakse protektorkaitseks.
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!