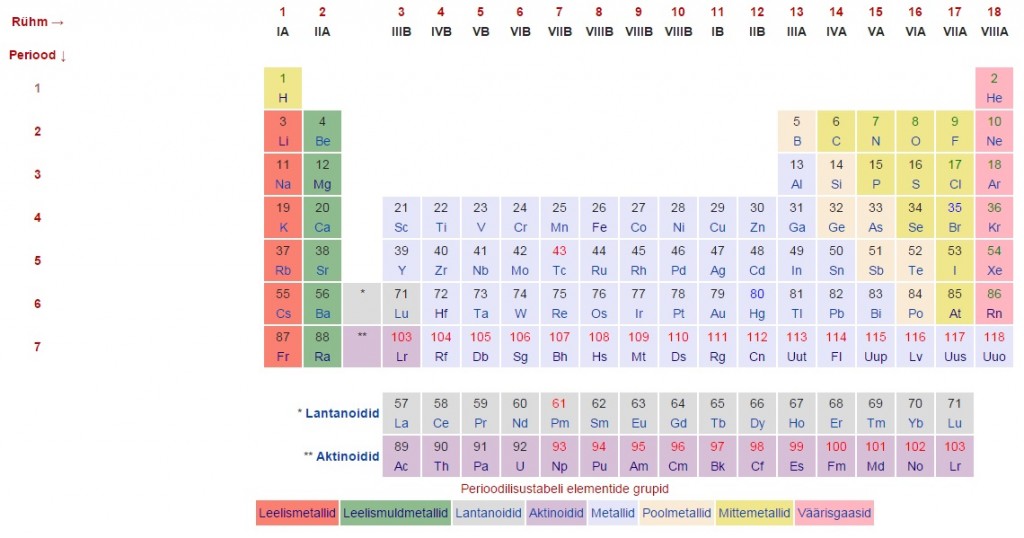
Keemiliste elementide perioodilisussüsteem ja selle ülesehitus
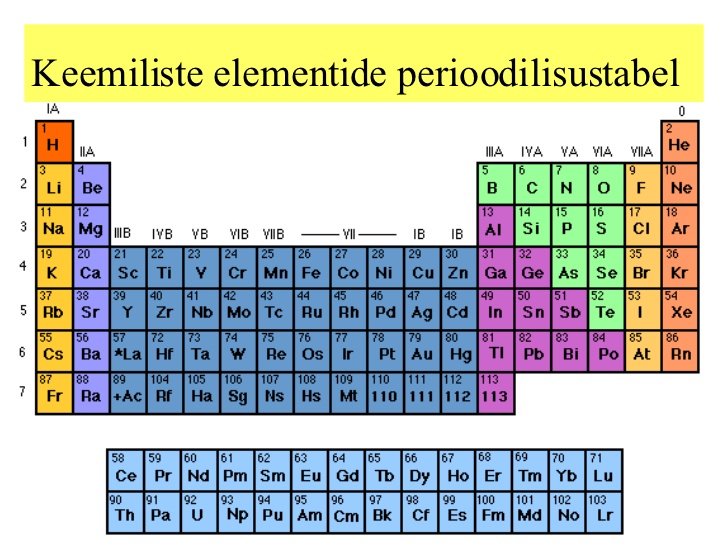
Keemiliste elementide perioodilisussüsteemis on elemendid paigutatud tabelisse kindlate seaduspärasuste ning elementide omaduste muutumise järgi. Perioodilisustabel jaguneb perioodideks (tabeli read) ning rühmadeks (tulbad).
Perioodilisustabelis on elemendid paigutatud aatomnumbri kasvu järjekorras nii, et ühes rühmas on sarnaste omadustega elemendid.
Sulle võivad huvi pakkuda need õppematerjalid:
Ioonid
Ионы
Tutvus keemiaga
Oksüdatsiooniaste
Атомы и молекулы
Lahused
Растворы
Знакомство с химией
Aatomid ja molekulid
Perioodilisussüsteemi kujutamiseks on mitmeid viise. Enamasti kujutatakse seda tabelina, mille veerud moodustavad 18 rühma ja read seitse perioodi. Rühmad on tihti jagatud ka kaheksaks pea- ja kaheksaks kõrvalalarühmaks ehk A- ja B-rühmadeks, mida tähistatakse rooma numbritega I–VIII.
Lantanoidid ja aktinoidid paigutatakse enamasti eraldi peatabeli alla.
Iga keemilise elemendi lahtris on tavaliselt elemendi tähis, aatomnumber ja aatommass, aga sinna võidakse märkida ka nimetus, elektronegatiivsus, väliselektronkihi konfiguratsioon jms.
Praeguse seisuga kuulub süsteemi 118 elementi, mille olemasolu on tõestatud. Neist 98 on leitud loodusest, ülejäänud on saadud tehislikult. Esimesed 80 elementi on stabiilsed sealt edasi radioaktiivsed.
Perioodilisussüsteemi ülesehitus
Elementide paigutus perioodilisussüsteemis
Elementide järjekorra tabelis määrab aatomnumber. Elemendi kuuluvuse perioodi määrab elektronkihtide arv ja kuuluvuse rühma valentselektronide arv väliselektronkihis.
Keemiliste omaduste alusel rühmitatakse elemente metallideks, poolmetallideks, mittemetallideks, leelismetallideks, leelismuldmetallideks, halogeenideks, väärisgaasideks, lantanoidideks, aktinoidideks.
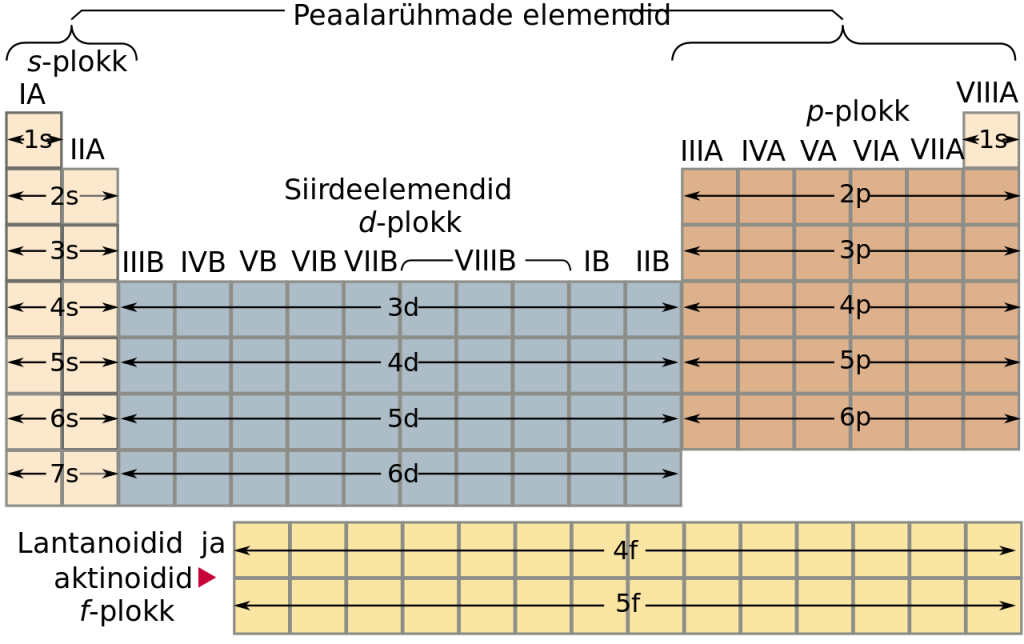
Elektronkonfiguratsiooni alusel jagatakse tabel s- p-, d- ja f-plokiks vastavalt sellele, millisel orbitaalil paikneb suurima energiaga elektron. s-elemendid paiknevad IA ja IIA rühmas, p-elemendid IIIA-VIIIA rühmas, d-elemendid B rühmades ning f-elemendid on lantanoidid ja aktinoidid (enamasti paigutatakse need eraldi tabeli alla).
Rühmad
Tabeli veerud moodustavad 18 rühma. Rahvusvaheline Puhta Keemia ja Rakenduskeemia Liit (IUPAC) soovitab rühmade tähistamiseks kasutada numeratsiooni 1 kuni 18. Varem tähistati rühmi roma numbritega I-VIII ning jagati A-rühmadeks (uue numeratsiooni järgi rühmad 1-2 ning 13-18) ja B-rühmadeks (uue numeratsiooni järgi rühmad 3-12).
Samasse rühma kuuluvatel elementidel on ühesugune väliskihi elektronkonfiguratsioon ja seega ka sarnased keemilised omadused.
1. ehk IA-rühm
Kõik esimese rühma elemendid peale vesiniku on leelismetallid. Nad on kõige aktiivsemad metallid. Nende välisel ektronkihil on üks elektron; nimetatakse s-elementideks. Nende oksüdatsiooniaste ühendites on +I. Frantsium on neist ainuke, millel puuduvad stabiilsed isotoobid.
2. ehk IIA-rühm
Teise rühma elemente alates kaltsiumist nimetatakse leelismuldmetallideks;. Nende välisel elektronkihil on kaks elektroni ning neid nimetatakse s-elementideks. Oksüdatsiooniaste on neil ühendites +II.
3. – 12. Rühm ehk B rühma metallid.
Kõik B rühma metallid on kas d-elemendid või f-elemendid (tabli alla paigutatud lantanoidid ja aktinoidid on f-elemendid, mis kuuluvad 3. rühma).
Enamasti on neil väliskihil kaks elektroni ning peamine oksüdatsiooniaste on neil ühendites +2, kuid nad võivad ühendites moodustada ka teisi oksüdatsioniastmeid.
13. ehk IIIA-rühm
Neid elemente nimetatakse p-elementideks. Välisel elektronkihil on neil 3 elektroni, mistõttu on ühendites nende oksüdatsiooniaste +III. Siia rühma kuulub ka esimene mittemetall boor, teised selle rühma elemendid on metallid.
14. ehk IVA-rühm, ka süsinikurühm
Neid elemente nimetatakse p-elementideks. Välisel ektronkihil on neli elektroni, mistõttu on neil ühendites oksüdatsiooniaste -IV kuni +IV.
15. ehk VA-rühm, ka lämmastikurühm
Neid elemente nimetatakse p-elementideks. Välisel ektronkihil on viis elektroni, mistõttu saab ühendites olla neil elementidel oksüdatsiooniaste -III kuni +V.
16. ehk VIA-rühm, ka hapnikurühm
Neid elemente nimetatakse p-elementideks. Välisel ektronkihil on kuus elektroni, mistõttu saab ühendites olla neil elementidel oksüdatsiooniaste -II kuni +VI.
17. ehk VIIA-rühm, halogeenid
Neid elemente nimetatakse p-elementideks. Välisel ektronkihil on seitse elektroni, mistõttu saab ühendites olla neil elementidel oksüdatsiooniaste -I kuni +VII. Flooril, kui kõige aktiivsemal mittemetallil on ühendites alati oksüdatsiooniaste –I.
18. ehk VIIIA-rühm, väärisgaasid
18. rühma moodustavad kõige vähem aktiivsed elemendid ehk väärisgaasid. Välisel elektronlihil on neil kaheksa elektroni, mistõttu need elemendid teiste ainetega ühendeid moodustada ei taha.
Perioodilisussüsteemi seaduspärasusi
- Perioodis paremale liikudes suureneb väliskihil olevate elektronide arv.
- Rühmas ülalt alla liikudes suureneb elektronkihtide arv.
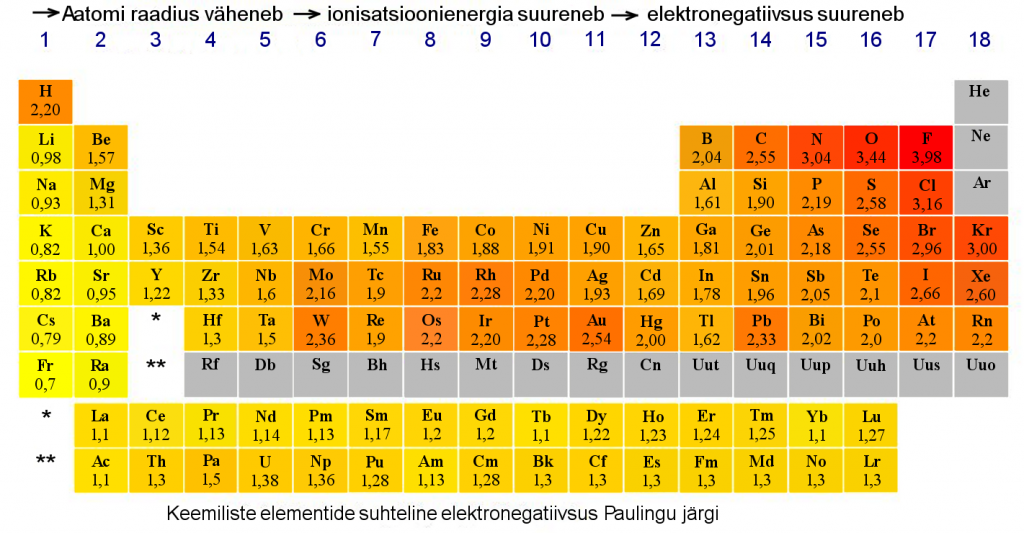
- Paremale liikudes aatomi raadius enamasti väheneb, sest tuumalaeng kasvab ning elektronid paiknevad seetõttu tuumale lähemal.
- Ülalt alla liikudes aatomi raadius kasvab, sest suureneb elektronkihtide arv.
- Vasakult paremale liikudes suurenevad mittemetallilised omadused, ülalt alla liikudes suurenevad metallilised omadused. Seega on kõige mittemetallilisem element fluor ning kõige metallilisemaks elemendiks loetakse tseesiumi (frantsiumi lihtainena pole veel saadud).
- Ülalt alla suureneb metallide puhul keemiline aktiivsus, sest reaktsioonis loovutatavad väliskihi elektronid on tuumast kaugemal ja sellega nõrgemini seotud.
- Mittemetallide aktiivsus ülalt alla väheneb, sest aatomi raadiuse kasvades väheneb võime liita elektrone.
TESTI ENNAST:
Perioodilisustabeli elementide grupid. 2 õiget vastust igal küsimusel.
Elementide avastamise ajalugu
Vaata lisaks:
Keemiliste elementide perioodilisussüsteem
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!