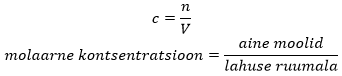Keemilise reaktsiooni kiirus
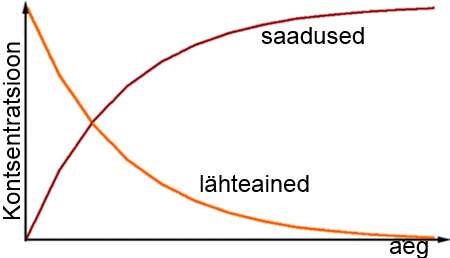
Keemilise reaktsiooni kiiruse all mõeldakse seda, kui kiiresti muutub ainete kontsentratsioon reaktsiooni käigus. Reaktsiooni kiirust võib väljendada lähteainete kontsentratsiooni vähenemisena või saadusainete kontsentratsiooni suurenemisena. Reaktsiooni kiirus ei ole ajas konstantne, vaid see on muutuv, kuna reaktsiooni kiirus sõltub reageerivate ainete kontsentratsioonidest.
Sulle võivad huvi pakkuda need õppematerjalid:
Lahused
Ионы
Ioonid
Растворы
Oksüdatsiooniaste
Aatomid ja molekulid
Атомы и молекулы
Знакомство с химией
Tutvus keemiaga
Kontsentratsiooni muutuse mõõtmiseks kastutatakse tavaliselt molaarset kontsentratsiooni. Molaarne kontsentratsioon (tähistatakse c tähega) näitab seda, mitu mooli ainet on ühes liitris lahuses. Molaarse kontsentratsiooni ühikuks on mol/dm3, mille lühend on M (1 M = 1 mol/dm3).
Keemilise reaktsiooni kiirust mõjutavad tegurid on: reageerivate ainete iseloom, ainete kontsentratsioon, temperatuur, tahkete ainete peenestusaste, rõhk (gaasiliste ainete korral), segamine, katalüsaatori kastutamine. Allpool on täpsemalt kirjeldatud, kuidas ja miks mingi tegur reaktsiooni kiirust mõjutab.
Reageerivate ainete iseloom. Erinevad ained on erineva reageerimisvõimega. Näiteks raud reageerib hapetega palju aeglasemalt, kui magneesium – reaktsiooni kiiruse erinevus on silmaga märgatav.
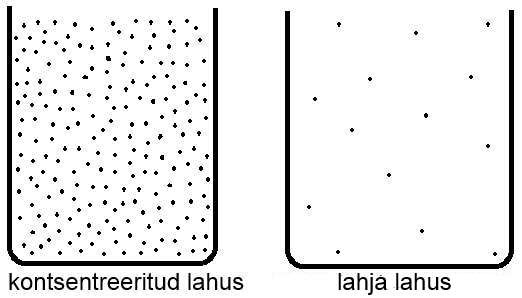
Reageerivate ainete kontsentratsioon. Ainete kontsentratsiooni suurendamine tähendab seda, et ühes ruumala ühikus on rohkem aine osakesi. Kuna aineosakesi on tihedamalt, siis toimub ka ainetevahelisi põrkeid rohkem ning tõenäosus, et toimub aktiivne põrge kahe osakese vahel on suurem. Seega mida suurem on ainete kontsentratsioon, seda kiiremini reaktsioon toimub.
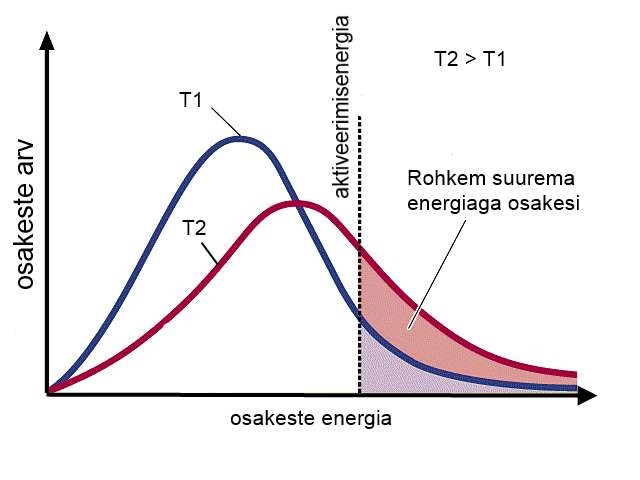
Temperatuur. Mida kõrgem on temperatuur, seda kiiremini reaktsioonid toimuvad. Kergesti saab vaadelda temperatuuri mõju reaktsiooni kiirusele ainete lahustumisel. Suhkur lahustub soojas vees palju kiiremini kui külmas vees. Temperatuur mõjutab reaktsiooni kiirust seepärast, et mida kõrgem on temperatuur, seda suurem on osakeste siseenergia ning seda kiiremini osakesed liiguvad. Kuna suurema energiaga osakesi on rohkem, siis toimub ka aktiivseid põrkeid rohkem, mis viivad keemilise reaktsiooni toimumiseni.
Tahkete ainete peenestusaste. Tahkete ainete korral toimub keemiline reaktsioon ainult tahke aine pinnal. Seega kui võtta kindel kogus ainet ühe tükina või pulbrina, siis pulbri korral on aine pind palju suurem ning seega toimub reaktsioon kiiremini. Kergesti on vaadeldav tahke aine peenestamine kriidi ja happe vahelisel reaktsioonil. Kriidi tükk reageerib palju aeglasemalt, kui sama kogus kriidipulbrit.
Rõhk (gaasiliste ainete korral). Rõhk mõjutab ainult gaasiliste ainete korral reaktsiooni kiirust, kuna gaasilisi aineid on võimalik kokku pressida, kuid vedelaid ja tahkeid aineid olulisel määral kokku pressida pole võimalik. Suurendades gaasiliste ainete korral rõhku, lähevad aineosakesed üksteisele lähemale – suureneb gaasi kontsentratsioon. Kui aineosakesed on üksteisele lähemal, siis saab ka suurema tõenäosusega toimuda rohkem aktiivseid põrkeid ning reaktsiooni kiirus suureneb rõhu tõstmisel.
Segamine. Segamine suurendab reaktsiooni kiirust. Kergesti on see vaadeldav suhkru lahustumisel – segades lahust, lahustub suhkur kiiremini. Segamine mõjutab kiirust seetõttu, et segades hakkavad aineosakesed kiiremini liikuma ning seetõttu on neil ka suurem energia. Mida rohkem on suurema energiaga osakesi, seda rohkem toimub ka aktiivseid põrkeid.
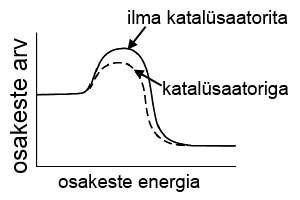
Katalüsaatori kasutamine. Katalüsaator on aine, mis kiirendab keemilist reaktsiooni, kuid ise reaktsiooni käigus ei muutu. Näiteks kui aine A reageerib ainega B ning tekib aine AB, siis katalüsaatori kasutamisel toimub summaarselt sama reaktsioon, kuid muutub reaktsiooni mehhanism. Aine A ei reageeri kohe ainega B, vaid kõigepealt katalüsaatoriga, tekitades vaheühendi Akat ning alles seejärel reageerib vaheühend Akat ainega B ning tekib aine AB ja eraldub katalüsaator.
A + kat = Akat
Akat + B = AB + kat
—————————–
A + B = AB
Katalüsaatori lisamine vähendab aktivatsioonienergiat, mis on reaktsiooni toimumiseks vajalik, seega saab keemiline reaktsioon toimuda väiksema energiaga osakeste kokkupõrkel. Väiksema energiaga osakesi on alati rohkem kui suurema energiaga osakesi ning seetõttu on ka reaktsiooni kiirus suurem.
Aineid, mis aeglustavad reaktsiooni, kuid ise reaktsioonist otseselt osa ei võta nimetatakse inhibiitoriteks.
Reaktsiooni kiirus (ing)
Kiiruskonstant (ing)
Katalüüs (ing)
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!