Keemiline tasakaal ja selle nihkumine
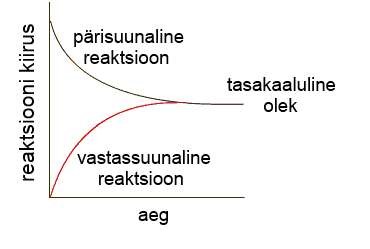
Tasakaalulisteks reaktsioonideks (pöördreaktsioonideks) nimetatakse neid reaktsioone, mis lõpuni ei kulge, vaid reaktsiooni segusse jäävad alati nii lähteained kui saadused. Tasakaalulised reaktsioonid on pöördreaktsioonid, kus alati toimub mõlema suunaline reaktsioon – lähteainetest tekivad saadused ning saadused lagunevad tagasi lähteaineteks. Näiteks on tasakaaluline reaktsioon ammoniaagi tekkimine lämmastikust ja vesinikust
Sulle võivad huvi pakkuda need õppematerjalid:
Lahused
Ионы
Ioonid
Растворы
Oksüdatsiooniaste
Aatomid ja molekulid
Атомы и молекулы
Знакомство с химией
Tutvus keemiaga
N2 + 3H2 = 2NH3
Selle reaktsiooni käigus ühinevad lämmastiku ja vesiniku aatomid ning tekib ammoniaak, kuid samas toimub ka reaktsioon, kus ammoniaak laguneb vesinikuks ja lämmastikuks.
Keemilise tasakaalu all mõeldakse seda, et ainete kontsentratsioon reaktsioonisegus ei muutu, vaid on püsiv. Kontsentratsiooni püsimine ei tähenda seda, et reaktsiooni enam ei toimub, vaid seda, et mõlema suunalise reaktsiooni kiirused on võrdsed. Nii kiiresti, kui tekib ammoniaak, see laguneb tagasi lähteaineteks.
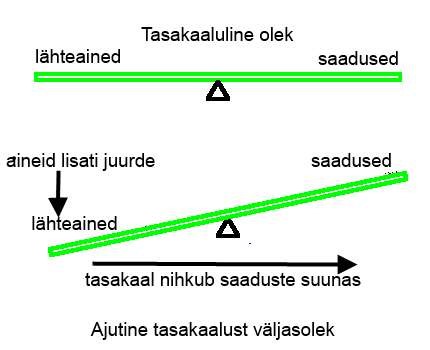
Keemilise tasakaalu nihkumise all mõeldakse seda, et muutub ainete kontsentratsioon uues tasakaalu olekus. Näiteks saaduste kontsentratsioon on suurem ning lähteainete kontsentratsioon väiksem, kui see oli enne tasakaalu nihutamist. Keemilise reaktsiooni tasakaalu saab muuta kolme teguriga: temperatuuri muutmine, ainete kontsentratsioonide muutmine, rõhu muutmine (gaasiliste ainete korral). Muutes ühte neist teguritest, muutub ka süsteemi tasakaal ning süsteemi tasakaal muutub selles suunas, mis on välistegurite mõjule vastupidine. Seda seadust, mis väidab, et süsteem töötab vastu välistegurite mõjule tuntakse kui Le Chatelier’i printsiipi.
Temperatuuri mõju keemilisele tasakaalule
Temperatuuri tõstmisel nihkub keemilise reaktsiooni tasakaal endotermilise reaktsiooni suunas. Näiteks ammoniaagi tekkereaktsioon on eksotermiline
N2 + 3H2 = 2NH3 ΔH < 0
Pärisuunalise reaktsiooni käigus eraldub energiat ning kui süsteemi kuumutada, siis püüab süsteem vähendada soojuse eraldumist. Seega peab tasakaal nihkuma vastassuunalise reaktsiooni (ammoniaagi lagumine) suunas, kuna see on endotermiline reaktsioon.
Pöördreaktsioonide korral on alati ühesuunaline reaktsioon (pärisuunaline või vastasuunaline) eksotermiline ning vastupidine reaktsioon endotermiline.
Kui ammoniaagi tekkereaktsiooni korral temperatuuri alandada, siis süsteem püüab temperatuuri alandamisele vastu töötada ning soojust juurde tekitada – reaktsiooni tasakaal nihkub eksotermilise reaktsiooni suunas, reaktsiooni käigus tekib rohkem saadusi.
Ainete kontsentratsiooni mõju keemilisele tasakaalule
Vaadeldes ammoniaagi tekkereaktsiooni
N2 + 3H2 = 2NH3
Kui tasakaalulises olekus suurendada lämmastiku kontsentratsiooni (lisades süsteemi lämmastikku), siis süsteem püüab sellele vastu töötada ning vähendada lämmastiku kontsentratsiooni. Ainuke võimalus selleks on tekitada juurde ammoniaaki (lämmastik reageerib ära), seega peab tasakaal nihkuma ammoniaagi tekke suunas. Kui vähenda mõne aine kontsentratsiooni, siis süsteem püüab selle aine kontsentratsiooni suurendada ning seega nihkub tasakaal sinnapoole, mille aine kontsentratsiooni vähendati.
Rõhu mõju keemilisele tasakaalule
Rõhk mõjutab ainult selliste reaktsioonide tasakaalu, milles osalevad gaasid, kuna ainult gaasilisi aineid on võimalik kokku pressida.
Muutes süsteemis rõhku, milles reaktsioon toimub, muudame gaasiliste ainete kontsentratsioone. Seal pool (lähteained, saadused), kus on gaasilisi aineid rohkem, muutub ka kontsentratsioon rohkem, seega püüab süsteem siis nihutada tasakaalu vastassuunas. Vaatleme ammoniaagi tekkereaktsiooni
N2 + 3H2 = 2NH3
Lähteainetes on kokku 4 mooli gaasilisi aineid (1 mool lämmastikku ning 3 mooli vesinikku) ning saadustes 2 mooli gaasilisi aineid. Suurendades süsteemis rõhku suureneb lähteainete kontsentratsioon rohkem, kui saaduste oma. Süsteem püüab sellele muutusele vastu töötada ning nihutab tasakaalu ammoniaagi tekke suunas (sinna kus on vähem moole gaasilisi aineid). Rõhu alandamine muudab tasakaalu vastupidiselt – rõhu alandamisel nihkub tasakaal sinna, kus on rohkem gaasilisi aineid.
VIDEOD:
Pöördreaktsioon (ing)
Keemiline tasakaal (ing)
Le Chatelier’i printsiip (ing)
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!