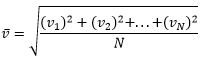Ideaalse gaasi rõhk
Ideaalne gaas on reaalse gaasi lihtsustatud mudel kus: (1) gaasimolekulid loetakse punktmassideks; (2) molekulide põrked anuma seintega on absoluutselt elastsed; (3) molekulide vahel puudub vastastikmõju ehk teiste sõnadega: (1) molekulide ruumala jäetakse arvestamata, (2) anuma seinaga põrkudes muutub ainult molekuli kiiruse suund, suurus jääb samaks ning (3) gaasimolekulide vahel ei mõju tõmbe- ega tõukejõude.
Sulle võivad huvi pakkuda need õppematerjalid:
Numbrilised seosed
Ratsionaalavaldised
Haridustreff 2023 loengud
Õpime tähti. Ö-täht
Harjuta eesti keelt A2-B1. Kuulamine
Eesti keele grammatika kordamine 5. klassile
Eesti keele grammatika kordamine 6. klassile
Eesti keele grammatika gümnaasiumile: täheortograafia
Jane Snaith. Traumateadlik kool
Eesti keele grammatika gümnaasiumile: numbrite kirjutamine
Liitmine 10 piires
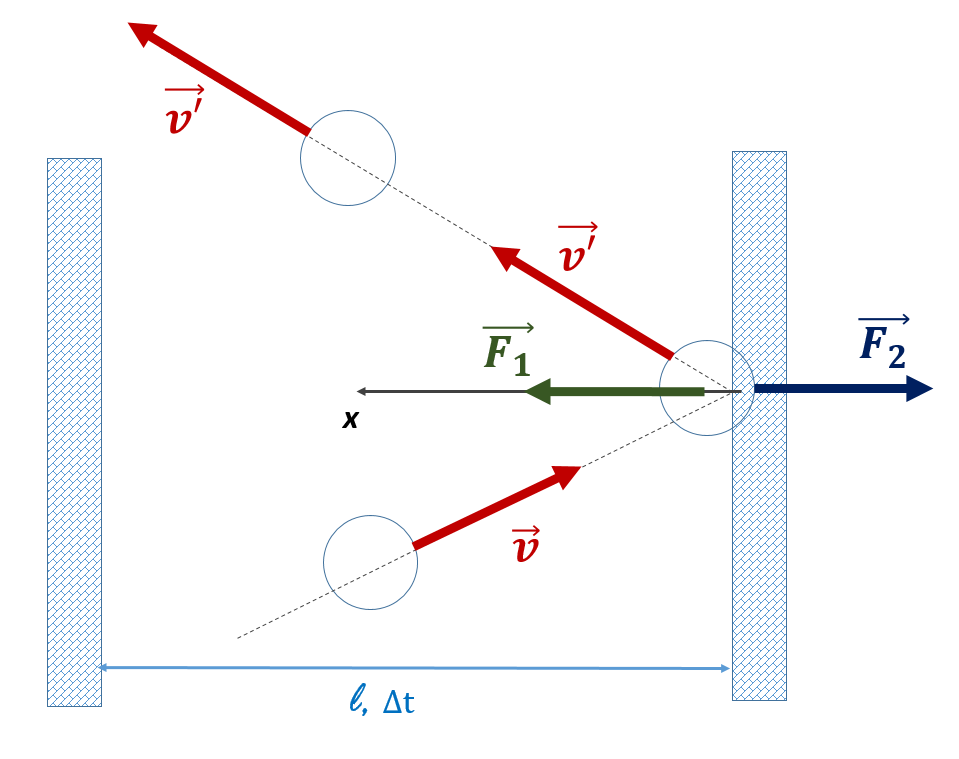
Ideaalse gaasi molekulid põrkuvad anuma seintega, nende liikumishulk (impulss) muutub ning seetõttu mõjutavad gaasimolekulid seina mingi jõuga.
Rõhk iseloomustab jõu (mida gaasimolekulid põrkudes seinaga avaldavad) mõju pinnaühikule:
Millest sõltub gaasimolekulide poolt anuma seintele avaldatav jõud?
(1) osakeste liikumiskiirusest: mida kiiremini osake liigub à seda rohkem muutub põrkudes osakese liikumishulk à seda suurem on seinale avaldatav jõud à seda suurem on rõhk
(2) osakese massist: mida suurem on osakese mass à seda suuremat mõju ta seinaga põrkudes avaldab à seda suurem on jõud à seda suurem on rõhk;
(3) osakeste kontsentratsioonist: mida rohkem on osakesi ruumalaühikus à seda rohkem põrkeid à seda suurem jõud seinale mõjub à seda suurem on rõhk.
Ülaltoodut arvestades saab näidata, et ideaalse gaasi molekulide poolt anuma ja seintele avaldatav rõhk, mis on kõikides suundades ühesugune, on arvutatav valmist:
kus: p – ideaalse gaasi poolt anuma seintele avaldatav rõhk, n – molekulide kontsentratsioon n=N/V (N– osakeste arv anumas; V – anuma ruumala), mõõdetühikuks 1m-3 – loe osakest kuupmeetri kohta, m0 – molekuli mass ning ![]() – molekulide ruutkeskmine kiirus, mis sisuliselt on kõikide gaasimolekulide kiiruste ruutude aritmeetiline keskmine ning sõltub sellest millise gaasiga on tegu ning eelkõige sellest, milline on selle gaasi temperatuur:
– molekulide ruutkeskmine kiirus, mis sisuliselt on kõikide gaasimolekulide kiiruste ruutude aritmeetiline keskmine ning sõltub sellest millise gaasiga on tegu ning eelkõige sellest, milline on selle gaasi temperatuur:
ANIMATSIOON:
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!