Hüdroksiidid ehk alused
Hüdroksiidid ehk alused on liitained, mis koosnevad metalli ioonist ja ühest või mitmest hüdroksiidioonist (OH–). Hüdroksiidioonide arv aluste valemis on võrdne metalli iooni oksüdatsiooniastmega.
Aluste valemite ja nimetuste koostamine
Valemite koostamisel kirjutatakse alati esimesena metalli sümbol ning selle taha OH (hüroksiidiooni tähis). Kui metalli oksüdatsiooniaste on suurem kui üks, siis kirjutatakse OH rühm sulgudesse ning sulgude taha indeksiks metalli o.a.
Sulle võivad huvi pakkuda need õppematerjalid:
Lahused
Ионы
Ioonid
Растворы
Oksüdatsiooniaste
Aatomid ja molekulid
Атомы и молекулы
Знакомство с химией
Tutvus keemiaga
Püsiva o.a väärtustega metallide hüdroksiidide nimetatakse põhimõttel
metalli nimetus + hüdroksiid
Näiteks:
NaOH – naatriumhüdroksiid
Ca(OH)2 – kaltsiumhüdroksiid
Al(OH)3 – alumiiniumhüdroksiid
Muutuva o.a-ga metallide hüdroksiidide nimetamisel tuleb ära markida ka metalli o.a väärtus Rooma numbriga (sama põhimõte, mis oksiidide nimetamisel).
metalli nimetus + metalli o.a (Rooma numbriga) + hüdroksiid
Näiteks:
Fe(OH)2 – raud(II)hüdroksiid
Fe(OH)3 – raud(III)hüdroksiid
Mn(OH)3 – mangaan(III)hüdroksiid
Kõikidele hüdroksiididele vastab kindel oksiid – aluseline oksiid. Hüdroksiidile vastava oksiidi metalli o.a on sama, mis see oli hüdroksiidis.
Aluste kindlaks tegemine
Hüdroksiide saab liigitada vastavalt nende vees lahustumisele. Vees lahustuvaid hüdroksiide nimetatakse leelisteks. Leeliste hulka loetakse ka vähelahustuvad alused, nagu kaltsiumhüdroksiid.
Leeliste kindlaks tegemiseks saab kasutada indikaatoreid. Näiteks fenoolftaleiin muutub aluselises keskkonnas punaseks. Vees lahustumatuid aluseid indikaatoritega kindlaks teha ei saa, kuna ained, mis vees ei lahustu, lahuse keskkonda ei mõjuta.
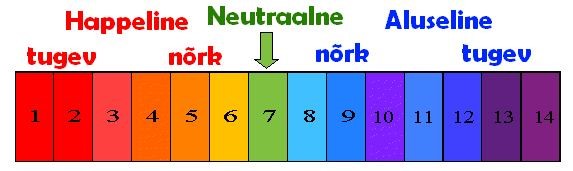
pH- skaalat ja universaalindikaatorit saab kasutada ka leeliselahuste tugevuse määramiseks. Mida aluselisem on lahus, seda sinisemaks (lillamaks) muutub indikaatori värvus (vt joonis)
Aluste keemilised omadused
Aluste üheks tähtsamaks omaduseks on reageerimine hapetega. Aluse ja happe omavahelist reaktsiooni nimetatakse ka neutralisatsioonireaktsiooniks. Happe ja aluse reaktsiooni tulemusena tekib sool ning vesi.
NaOH + HCl = NaCl + H2O
Vees lahustumatud (ja vähelahustuvad) alused kuumutamisel lagunevad andes vee ja vastava oksiidi
Ca(OH)2 = CaO + H2O
Cu(OH)2 = CuO + H2O
Seda tüüpi reaktsioone, kus ühest ainest tekib mitu erinevat ainet nimetatakse lagunemisreaktsioonideks.
Aluste saamine
Leeliseid ehk vees lahustuvaid aluseid saadakse vastavate oksiidide reageerimisel veega.
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!