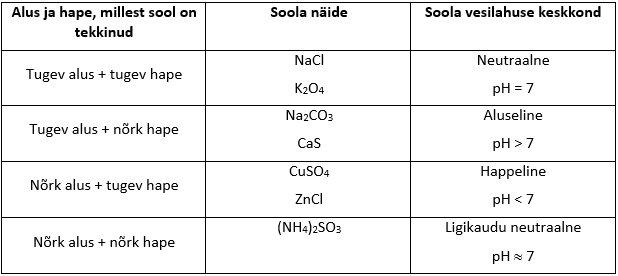
Keskkond hüdrolüüsuva soola lahuses, pH
Soolade hüdrolüüsiks nimetatakse soolade lagunemist vee toimeil. Hüdrolüüsil soolad dissotseeruvad ning tekkinud ioonid on vastastikmõjus vee molekulidega. Soolade vesilahuste keskkond võib olla nii neutraalne, aluseline kui happeline – see sõltub sellest, millisest happest ja alusest on sool tekkinud (vt tabel).
Soola vesilahuse keskkonna määramisel peab jälgima ka seda, et sool oleks vees lahustuv. Vees lahustumatud soolad lahusesse ioone ei anna, seega ei mõjuta nad ka lahuse keskkonda (lahus on neutraalne, kuna vesi on neutraalne). Näiteks CaCO3 on tekkinud tugevast alusest ja nõrgast happest, kuid selle soola vesilahus on neutraalne kuna kaltsiumkarbonaat vees ei lahustu.
Miks tugeva aluse ja nõrga happe soola vesilahus on aluseline?
Sulle võivad huvi pakkuda need õppematerjalid:
Tutvus keemiaga
Атомы и молекулы
Lahused
Aatomid ja molekulid
Oksüdatsiooniaste
Ионы
Растворы
Знакомство с химией
Ioonid
Uurime Na2CO3 vesilahuses toimunud protsesse.
Sool dissotseerub naatriumi ja karbonaatioonideks
Na2CO3 = 2Na+ + CO32-
Naatriumi ioonidel vee molekulidega vastastiktoime puudub, kuna naatriumhüdroksiid on tugev alus (ioonreaktsioonides ei saa tekkida tugevat elektrolüüti).
Na+ + H2O = reaktsioon puudub
Karbonaatioonid suudavad vee molekulidest siduda prootoni
CO32- + H2O = HCO3– + OH–
Kuna reaktsiooni tulemusena tekib lahusesse hüdroksiidioonide liig, siis tekkinud vesilahus on aluseline. Summaarselt on naatriumkarbonaadi ja vee vahelise reaktsiooni võrrand järgmine
Na2CO3 + H2O <=> NaHCO3 + NaOH
Sellest võrrandist on kohe näha, et tekkis tugev alus, seega on tekkinud vesilahuse keskkond aluseline. Antud reaktsioon on pöördreaktsioon, mis on tugevalt nihutatud vasakule. Reaktsiooni käigus ainult väike osa naatriumkarbonaati reageerib veega ning tekib hüdroksiid, enamus naatriumkarbonaati jääb siiski lahusesse soolana (ioonidena).
Miks nõrga aluse ja tugeva happe soola vesilahus on happeline?
Uurime CuSO4 vesilahuses toimunud protsesse.
Sooldissotseerub vase ja sulfaatioonideks
CuSO4 = Cu2+ + SO42-
Vee molekulid sulfaatioone ei mõjuta
SO42- + H2O = reaktsioon puudub
Vase ioonid seovad vee molekulist hüdroksiidiooni
Cu2+ + H2O = CuOH+ + H+
Reaktsiooni tulemusena tekib lahusesse vesinikioonide liig, mis muudab lahuse happeliseks. Summaarselt saame vee ja vasksulfaadi vahelise hüdrolüüsi võrrandi kirja panna järgmiselt
CuSO4 + 2H2O <=> Cu(OH)2 + H2SO4
Võrrandist on näha, et tekkis tugev hape, mis muudab soola vesilahuse happeliseks.
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!