IIA rühma metallid
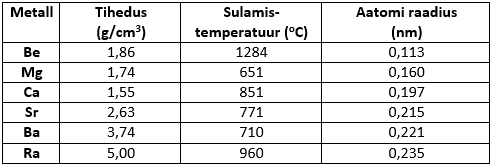
Sellesse rühma kuuluvad leelismuldmetallid – kaltsium, strontsium, baarium ja raadium. Lisaks neile metallidele kuuluvad IIA rühma veel magneesium ja berüllium. Oma omaduste poolest erineb berüllium teistest metallidest. Tema metallilised omadused on nõrgemad kui teistel IIA rühma metallidel ning tal on amfoteersed omadused. (Amfoteerseteks ainetes nimetatakse aineid, mis reageerivad nii hapete kui alustega). Kõige levinum selle rühma metall kaltsium, mida leidub looduses kaltsiumkarbonaadina lubjakivi, paekivi, kriidi, marmori jt. mineraalide koostises. Looduses on tähtsal kohal ka kaltsiumkarbonaadi muutumine süsinikdioksiidi toimel vees lahustuvaks kaltsiumvesinikkarbonaadiks. Selline pöördreaktsioon on aluseks karstikoobaste tekkimisel ning stalaktiitide ja stalagmiitide tekkimisel.
Füüsikalised omadused
Sulle võivad huvi pakkuda need õppematerjalid:
Tutvus keemiaga
Aatomid ja molekulid
Ioonid
Oksüdatsiooniaste
Lahused
Растворы
Атомы и молекулы
Знакомство с химией
Ионы
Keemilised omadused
Berüllium ja magneesium on ainukesed IIA rühma elemendid, mis ei ole leelismetallid. Seetõttu on ka berülliumi ja magneesiumi omadused võrreldes leelismetallidega natuke teistsugused. Berüllium on ainukt IIA rühma metall, millel on amfoteersed omadused. Allpool on kaltsiumi näol ära toodud tüüpilised IIA rühma metallide reaktsioonid.
2Ca + O2 = 2CaO
Ca + S = CaS
Ca + Cl2 = CaCl2
Ca + H2 = CaH2
Ca + H2SO4(lahj) = CaSO4 + H2
Ca + 2H2O = Ca(OH)2 + H2
Osade nimetatud reaktsioonide toimumine sõltub reageerivast metallist. Näiteks berüllium reageerib hapnikuga vaid kuumutades, kuid teised metallid kattuvad oksiidi kihiga juba õhu käes seistes. Vesinikuga reageerides annavad kõik IIA rühma metallid hüdriide – ühendeid, kus vesiniku o.a. on -1.
Tuntumad ühendid
Kaltsiumkarbonaat (CaCO3) on kõige tähtsam IIA rühma metallide ühend. Kaltsiumkarbonaat on peamine paekivi, marmori, kriidi ja lubjakivi koostisosa.
Kaltsiumoksiid ehk kustutamata lubi (CaO) saadakse peamiselt lubjakivi lagunemisel. Kustutatud lubja reageerimisel veega saame kustutatud lubja.
Kaltsiumhüdroksiid ehk kustutatud lubi (Ca(OH)2) leiab kasutust ehitusel. Kustutatud lubja suspensiooni veega nimetatakse lubjapiimaks ning lubja vee ja liiva segu on lubimört. Kaltsiumhüdroksiidi vesilahust kasutatakse ka süsihappegaasi kiireks tuvastamiseks – kaltsiumhüdroksiidi vesilahuse ja CO2 vahelisel reaktsioonil tekib vees lahustumatu kaltsiumkarbonaat.
Ca(OH)2 + CO2 = CaCO3 + H2O
Kaltsiumsulfaadi kristallhüdraat (CaSO4·0,5H2O) on põletatud kips, mida kasutatakse ehitusel sideainena.
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!