Fosfor
Üldine
Fosfor on Maal üpriski levinud element. Teda leidub nii mineraalidena maakoores kui ka eluslooduse koostises. Mineraalidena leiavad kõige suuremat kasutust fosforiit ja apatiit, mida leidub ka Eesti põhjaosas – suuremad fosforiidimaardlad asuvad Rakveres, Aseris, Toolsel ja Tsistres. Fosforiidi ja apatiidi peamine koostisosa on kaltsiumfosfaat (Ca3(PO4)2).
Fosfori tootmine toimub fosforiidi kuumutamisel söe ja liivaga.
2Ca3(PO4)2 + 10C + 6SiO2 = 6CaSiO3 + 10CO + P4
Fosfori mineraale kasutatakse peamiselt väetistena. Kõige lihtsam fosforväetis on fosforiidijahu, mida saadakse fosforiidi peenestamisel. Kuna fosforiühendid on halvasti lahustuvad, siis taimed omandavad fosforiidijahust fosfori kehvasti, seetõttu leiab suuremad kasutust superfosfaat, mida saadakse fosforiidi töötlemisel väävelhappega.
Sulle võivad huvi pakkuda need õppematerjalid:
Tutvus keemiaga
Ioonid
Lahused
Растворы
Aatomid ja molekulid
Знакомство с химией
Ионы
Атомы и молекулы
Oksüdatsiooniaste
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
Kuna superfosfaat sisaldab ka mõningal määral vaba fosforhapet, siis omastavad taimed seda väetist palju paremini. Fosforväetisi ja teisi mineraalväetisi ei tohi liigselt kasutada, kuna kui need satuvad veekogudesse, siis hakkavad seal vetikad kiiresti vohama ning väiksed veekogud kasvavad kiiresti kinni.
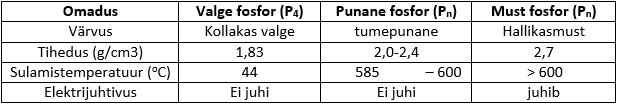
Fosfor võib esineda mitme erineva allotroobina. Tuntumad fosfori allotroobid on punane fosfor, valge fosfor ning must fosfor. Tabelis on ära toodud fosfori allotroopide omadused.
Keemilised omadused
Fosforil on väliskihis kuus elektroni (ns2np4) ning seetõttu võib ta keemilistes reaktsioonides käituda nii redutseerijana kui ka oksüdeerijana. Oksüdeerijana käitub fosfor metallide ja vesiniku suhtes ning redutseerijana reageerides hapnikuga, halogeenidega või väävliga. Oksüdeerijaga reageerides võivad tekkida fosfori ühendid oksüdatsiooniastmega +3 kui ka +5, sõltuvalt tingimustest. Näiteks õhus põledes tekib nii fosfor(III)oksiid kui ka fosfor(V)oksiid.
4P + 3O2 = P4O6
4P + 5O2 = P4O10
Vesinikuga fosfor otseselt ei reageeri. Vesiniku ja fosfori ühendit fosfaani (PH3) saadakse kaudsel teel, näiteks alumiiniumfosfiidi reageerimisel veega.
AlP + 3H2O = Al(OH)3 + PH3
Fosfiini peetakse ka üheks virvatulede põhjustajaks soodes.
Ühendid
Fosforhape ehk ortofosforhape (H3PO4) leiab fosfori hapetest kõige rohkem kasutust. Enim kasutab fosforhapet mineraalväetiste tööstus. Üheks fosforhappe saamise võimaluseks on loodusliku kaltsiumfosfaadi töötlemine väävelhappega.
Ca3(Po4)2 + 3H2SO4 = 2H3PO4 + 3CaSO4
Tetrafosfordekaoksiid (P4O10) on tahke valge aine, mis aurustub juba 36 oC juures. Tetrafosfordekaoksiid on peamine saadus, mis tekib fosfori põlemisel ning põhjustab ka suitseva leegi, mistõttu kasutatakse fosforit suitsuefektide tekitamisel.
Tetrafosforheksaoksiid (P4O6) tekib fosfori põlemisel kõrvalsaadusena. Kuna P4O6 on mürgine, siis peab olema fosforiga ümberkäimisel ning suitsuefektide tekitamisel väga ettevaatlik.
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!