Hapnik
Üldine
Hapnik on Maal kõige levinum keemiline element, mida leidub nii maakoores, veekogudes kui õhus. Õhus leidub hapnik lihtainena, moodustades õhu koostisest 21% ruumala järgi. Puhast hapniku saadakse peamiselt vedela õhu destilleerimisel ning vee elektrolüüsil. Õhus leiduv hapnik tekib peamiselt taimede fotosünteesireaktsioonil, kus taimed toodavad süsihappegaasist ja veest glükoosi ning kõrvalsaadusena tekib ka hapnik
Sulle võivad huvi pakkuda need õppematerjalid:
Lahused
Ионы
Ioonid
Растворы
Oksüdatsiooniaste
Aatomid ja molekulid
Атомы и молекулы
Знакомство с химией
Tutvus keemiaga
6CO2 + 6H2O = C6H12O6 + CO2
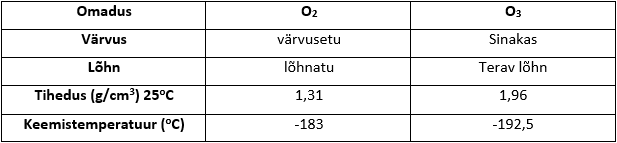
Hapnikul on olemas kaks isotoopi – dihapnik (O2) ja trihapnik (O3) ehk osoon. Oma keemiliste ja füüsikaliste omaduste poolest on need isotoobid erinevad
Dihapniku ja trihapniku võrdlus:
Kuna hapnik soodustab põlemist, siis hapniku peamine kasutusala ongi õhu rikastamine hapnikuga. Juba mõneprotsendiline hapnikusisaldus õhus suurendab reaktsiooni kiirust kahekordselt ning puhtas hapnikus toimub paljude ainete põlemine väga kõrgel temperatuuril. Metallurgias kasutatakse hapniku kõrge temperatuuri saavutamiseks metallide sulatamisel. Hapniku kasutatakse ka meditsiinis inimestele lisahapniku andmisel, kes seda vajavad.
Osoon on mürgine ühend. Inimestele on eluohtlik juba 10-5 protsendiline osooni sisaldus õhus. Osoon on väga tugev oksüdeerija ning teda kasutatakse pleegitajana kohtades, kus kloori kasutada ei saa. Osoon on ohtlik tänu oma tugevatele oksüdeerivatele omadustele, kuid lisaks sellele on osooni ja õhu segu ka väga plahvatusohtlik, mistõttu välditakse osooni transportimist, vaid seda toodetakse kohapeal. Osooni leidub ka atmosfääri ülemistes kihtides, kus ta kaitseb Maad liigse ultraviolettkiirguse eest – osoon neelab UV-kiirgust.
Keemilised omadused
Hapnik moodustab peaaegu kõikide keemiliste elementidega (nii metallide kui ka mittemetallidega) oksiide. Enamus ainetega reageerib kloor otseselt, välja arvatud väärisgaasid, kuld ja plaatina, kus oksiide saadakse kaudsel teel.
2Ca + O2 = 2CaO
S + O2 = SO2
C + O2 = CO2
Erandiks on neoon ja argoon, mis hapnikuga ühendeid ei moodusta ning fluor, millega reageerides käitub hapnik redutseerijana – tekib ühend, kus hapniku oksüdatsiooniaste on +2.
2F2 + O2 = 2OF2
Ühendid
Hapniku üheks kõige tähtsamaks ühendiks on divesinikmonooksiid ehk vesi (H2O). Vesi katab 75% Maast ning ta on olemas ka õhus ning pinnases. Vesi on ka kõige levinum lahusti, mida kasutatakse nii argielus, kui ka keemiatööstuses.
Kasutust leiab ka vesiniku ja hapniku ühend vesinikperoksiid (H2O2), mida kasutatakse pleegitajana. Näiteks leidub vesinikperoksiidi juuste blondeerimisvahendites.
Keemia test:
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!