Elektrolüüs
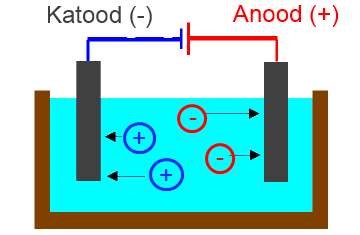
Elektrolüüsiks nimetatakse keemilist reaktsiooni elektrivoolu toimel. Elektrolüüsi läbiviimiseks paigutatakse elektrolüüsi nõusse kaks elektroodi – anood (+) ja katood (-), mis on ühendatud vooluallikaga. Katoodil toimub alati elektronide liitmine ning anoodil elektronide loovutamine. Elektrolüüsi korral liiguvad katioonid katoodile ning liidavad elektrone ning anioonid liiguvad anoodile ja loovutavad elektrone.
Sulle võivad huvi pakkuda need õppematerjalid:
Ионы
Aatomid ja molekulid
Oksüdatsiooniaste
Растворы
Ioonid
Знакомство с химией
Tutvus keemiaga
Lahused
Атомы и молекулы
Elektrolüüsi saab läbi viia elektrolüütide vesilahustes või sulatatud elektrolüütides. Sulatatud elektrolüütide elektrolüüsi toodetakse aktiivseid metalle (naatrium, kaalium, kaltsium, jt).
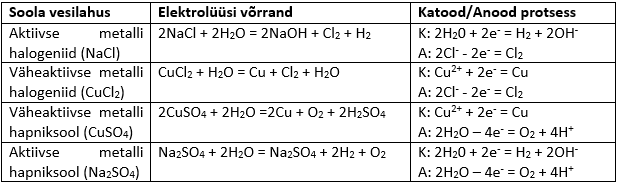
Elektrolüüdi vesilahuste korral sõltuvad saadused sellest, millise elektrolüüdiga on tegemist. Allolevas tabelis on ära toodud erinevat tüüpi soolade vesilahuste elektrolüüsi saadused.
Vesilahuses ei saa tekkida aktiivset metalli, seega toimub aktiivse metallisoola korral katoodil vee lagunemine (tekib vesinik), mitte metalli sadenemine. Hapnikanioonid elektrolüüsil ei lagune, seega laguneb hapniksoolade korral anoodil vesi ning tekib hapnik.
Elektrolüüsi rakendused (ing)
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!