Aatomimudelid
Atomism
Vana-Kreeka filosoofid – atomistid (Demokritos 5. saj. eKr) olid seisukohal, et kõik kehad koosnevad jagamatutest koostisosakestest – aatomitest. Atomistide käsitluses oli aatomeid 5 liiki: tuli, vesi, maa, õhk, eeter. 19. sajandi alguseks oli siiski teada, et erinevaid aatomeid on kokku umbes 100 erinevat liiki.
Tänapäevase atomistliku printsiibi kohaselt ei saa ainet (kehi) lõputult väiksemateks osadeks jagada nii, et saadud osadel säiliksid kõik jagatava terviku omadused.
Meid ümbritsevad kehad koosnevad ainetest, mille väikseimaks koostisosakeseks on molekul. Molekule on võimalik jagada omakorda teineteisega sarnaseks aatomiteks (kokku ca 120+ erinevat).
Aatomid omakorda koosnevad tuumast ja elektronkattest. Tuuma moodustavad omavahel vastastikmõjus olevad prootonid ja neutronid, elektronkatte aga elektronid.
Sulle võivad huvi pakkuda need õppematerjalid:
Harjuta eesti keelt A2-B1
INETU PARDIPOEG. Muinasjutt kuulamiseks
Õpime tähti. I-täht
Õpime tähti. D-täht
Eesti keele grammatika gümnaasiumile: täheortograafia
Ruutjuur, tehted ruutjuurtega
Атомы и молекулы
KEISRI UUED RÕIVAD. Muinasjutt kuulamiseks
Eesti keele grammatika gümnaasiumile: kirjavahemärgid
Funktsioonid ja nende graafikud
Kirjalik liitmine
Rahvakalender lastele: KADRIPÄEV
Õpi eesti keelt teise keelena B2. Kuulamine
Liitmine ja lahutamine 10 piires
Peastarvutamine eelkoolile
Tähestik, tähestikuline järjekord, häälikute jagunemine
Kogu kaasaegne katseliselt kontrollitud osakeste füüsika lähtub Osakeste Standardmudelist, mille kohaselt aine koosneb kaheteistkümnest fundamentaal- ehk alusosakesest: kuuest leptonist ja kuuest kvargist. Need ongi aine füüsikalised algosakesed tänapäevases tähenduses.
Daltoni piljardipallimudel
Esimese tänapäeva mõistes tõsisemalt võetava katse kirjeldada aatomit tegi John Dalton 1803. a.
Daltoni mudeli kohaselt olid aatomid homogeensed ja kerakujulised (läbimõõduga ca 100 pm) nagu piljardipallid. Kõik lihtaine aatomid olid kõik ära vahetamiseni ühesugused. Liitainete aatomid aga koosnevad erinevate elementide aatomitest.
Daltoni teooria kohaselt keemiliste reaktsioonide käigus aatomid ei muutu, nad paiknevad reaktsioonide käigus teineteise suhtes ümber, ainekoguse mass tervikuna aga ei muutu.
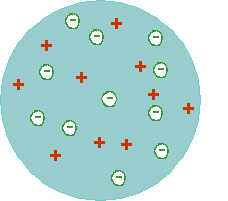
Thomsoni rosinasaiamudel
1870-del aastatel avastati katoodkiired – negatiivse elektrilaenguga “kiired”, mis tekivad vaakumisse asetatud metallitükil, mis on ühendatud vooluallika negatiivse poolusega. 1896 aastal avastas inglise füüsik Joseph John Thomson, et katoodkiired koosnevad väikestes negatiivse laenguga osakestest, mida ta hakkas nimetama elektronideks (Nobeli preemia 1906).
Thomsoni oletuse kohaselt pärinesid tema poolt avastatud elektronid aatomitest – järelikult ei saa aatomid olla homogeensed.
Nii kirjeldas Thomson aatomit kui rosinasaia (tuntud ka ploomipudingi mudelina):
Selle kohaselt on aatomid on kerakujulised (läbimõõduga ca 100 pm) ning täidetud positiivse elektrilaengu massiga (nagu saias küpsetatud tainas), millesse on pikitud negatiivselt laetud osakesi – elektrone (nagu rosinad saias), mis saavad teatud tingimustel aatomist lahkuda – saavad tekkida katoodkiired.
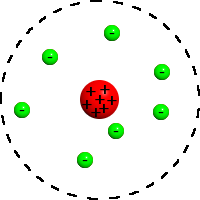
Rutherfordi õhupallimudel
Uus-Meremaa päritoluga Briti füüsik Ernest Rutherford, keda tema kaasaegsed pidasid parimaks eksperimenteerijaks pärast Michael Faraday aega, püüdis 1909. aastal kontrollida Thomsoni aatomimudeli paikapidavust. Tema hüpotees oli: pommitades ainet “raskete” positiivsete alfa-osakestega (heeliumi aatomi tuumadega), peaks enamik osakestest jääma ainesse kinni ja selle tulemusena peaks aine laaduma positiivselt.
Rutherford pommitaski (vt videot) väga õhukest kuldlehte alfaosakestega ning tõdes, et (1) enamik nendest osakestest läks sellest (peaaegu) suunda muutmata läbi, (2) mingi hulk osakesi põrkas aga lehelt tagasi.
Katse tulemusena esitas Rutherford uue niinimetatud õhupallimudeli, mille kohaselt: (1) enamus aatomist läbimõõduga 100pm on tühi, (2) aatomi keskel asub väike (umbes aatomi mõõtudest 10 tuhat korda väiksem) massiivne tuum, millesse on koondunud positiivne elektrilaeng, (3) tuuma mass on ligikaudu võrdne aatomi kogumassiga ning (4) elektronid “hõljuvad” tuumalähedases ruumis nagu õhupallid.
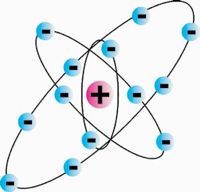
Bohr’i planetaarmudel
Taani füüsikut Niels Bohr’i häiris Rutherfordi elektronide “õhupallikäsitlus” – negatiivse laenguga elektronid peaksid langema tuumale, mille tulemusena aatom häviks.
Võrrelnud massijaotust aatomis massi jaotumisega Päikesesüsteemis, täiendas Bohr Rutherfordi mudelit, pannes elektronid tiirlema ümber tuuma nagu tiirlevad planeedid ümber Päikese – sündis Rutherfordi-Bohr’i planetaarmudel.
On teada, et kiirendusega liikuv elektrilaeng, aga ringjoonel liikuv elektron täidab seda tingimust, peab kiirgama elektromagnetlaineid – näiteks valgust. Enamik aatomeid enamuse ajast valgust ei kiirga.
Kuna tollaste teadmistega polnud võimalik kujunenud vastuolu lahendada, sõnastas Bohr postulaadid, mille kohaselt:
- võivad elektronid tiirelda vaid tuumast kindlatel kaugustel asuvatel orbiitidel, millest igaühele vastab kindel energia. Sellistel statsionaarsetel orbiitidel liikuvad elektronid elektromagnetlaineid ei kiirga.
- II. kiirgab aatom valgust (valgusosakese – footoni) kui elektron temas läheb suurema energiaga orbiidilt madalama energiaga orbiidile, kui elektron läheb madalama energiaga orbiidilt kõrgema energiaga orbiidile, toimub valguse (osakese – footoni) neeldumine.
TEST:
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!